题目内容
【题目】人们的日常生活离不开金属,高科技新材料的开发和应用也需要金属。
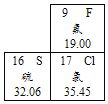
(1)地壳中含量最高的金属元素是_____。
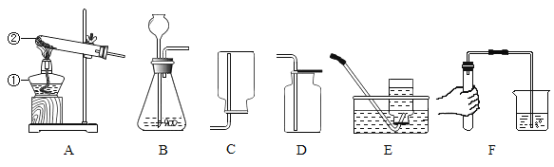
(2)根据下图的金属应用实例推断,金属具有的物理性质有_______

(3)日常使用的金属材料多数属于合金。下表列出了一些常见合金的主要成分和性能。
合金 | 合金的主要性能 | 主要成分及纯金属的性能 |
焊锡 | 熔点183℃ | 锡:熔点232℃;铅:熔点327℃。 |
硬铝 | 强度和硬度好 | 铝、铜、镁等。硬度小,质软。 |
不锈钢 | 抗腐蚀性好 | 铁、铬、镍等。纯铁抗锈蚀性能不如不锈钢。 |
由上表可以推断,与组成合金的纯金属相比,合金的优点一般有(填序号)______。
①强度更低 ②硬度更高 ③熔点更高 ④抗腐蚀性能更好
(4)2008年奥运会主运动场“鸟巢”使用了大量的钢铁。钢铁与_______、_______直接接触容易生锈造成损失,在钢铁表面涂油、刷漆等,都能防止钢铁生锈。
【答案】Al 导电性 延展性 导热性 ②④ 氧气 水
【解析】
(1)地壳中含量最多的四种元素是:氧、硅、铝、铁,最多的金属元素是铝;
故填:Al。
(2)观察图中的金属,作导线利用金属具有导电性;拉成丝利用金属具有延展性;作炊具利用了金属能导热;故金属具有的物理性质有导电性、延展性、导热性;
故填:导电性 延展性 导热性。
(3)观察表中纯金属与合金的性能比较,合金比纯金属具有的优点:熔点低、强度高、硬度大、抗腐蚀性能好;
故选:②④。
(4)钢铁与空气中的水和氧气反应生成铁锈;
故填:氧气;水。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
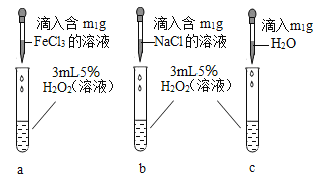
欣语文化快乐暑假沈阳出版社系列答案【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,小明同学想:
Ⅰ、氧化铜能否起到类似二氧化锰的催化作用呢?于是进行了以下探究: .
[猜想] a 氧化铜不是催化剂,也不参与反应,反应前后质量和化学性质不变。
b 氧化铜参与反应,反应前后质量和化学性质发生了改变。
c 氧化铜是反应的催化剂,反应前后_______________________。
[实验]用天平称量0.2g氧化铜,取5mI5%的过氧化氢溶液于试管中,实验过程如下:
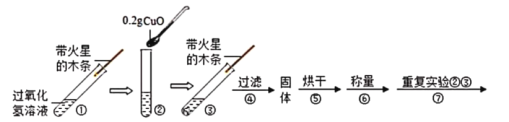
(1)步骤⑥称量结果的数值是__________________________________;
(2)步骤⑦的现象是溶液中有大量气泡产生,带火星木条__________________;由此可得出结论:猜想c成立。
(3)步骤①的作用是_____________________。
Ⅱ、以下是小明同学探究影响反应速率部分因素的相关实验数据。
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液体积/ml | 温度/°C | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/S |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 1 | 35 | 2 | 49.21 | |
④ | 30 | 1 | 55 | 2 | 10.76 |
(4)通过实验①和②对比可知,化学反应速率与______________________________有关;从实验③和①对比可知,化学反应速率与温度的关系是________________________________;
[注意:若笞对下列小题奖励2分,化学试卷总分不超过40分]
(5)高锰酸钾和氯酸钾混合加热制取氧气,开始产生氧气的速率较慢,一段时间后速率明显加快的原因是_______________________________。