题目内容
如表列出了部分酸、碱、盐在20℃时的溶解性.利用此表完成下列问题:
(1)写出表中空格处物质的化学式
(2)查:CaSO4的溶解性
(3)工业上常用表格中的两种酸(HCl或H2SO4)除铁锈(铁锈的主要成分是Fe2O3),该反应的化学方程式是(只要求写出其中一个,如果两个都写,且正确可另加2分,但全卷总分不超过100分):
(4)BaCl2、Na2SO4这两种盐溶液能否发生反应?如果能,请写出化学方程式;如果不能,请简要地说明理由.答:
(5)从上表中选择并写出一个能生成不溶物,且属于中和反应的化学方程式
| 离子 | OH- | Cl- |
| ||
| H+ | 溶、挥 | 溶 | |||
| Na+ | 溶 | 溶 | 溶 | ||
| Ca2+ | 微 | 溶 | 微 | ||
| Ba2+ | 溶 | 溶 | 不 |
H2O
H2O
;(2)查:CaSO4的溶解性
微溶
微溶
;(3)工业上常用表格中的两种酸(HCl或H2SO4)除铁锈(铁锈的主要成分是Fe2O3),该反应的化学方程式是(只要求写出其中一个,如果两个都写,且正确可另加2分,但全卷总分不超过100分):
6HCl+Fe2O3═2FeCl3+3H2O
6HCl+Fe2O3═2FeCl3+3H2O
、Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
;(4)BaCl2、Na2SO4这两种盐溶液能否发生反应?如果能,请写出化学方程式;如果不能,请简要地说明理由.答:
能,BaCl2+Na2SO4═BaSO4↓+2NaCl
能,BaCl2+Na2SO4═BaSO4↓+2NaCl
;(5)从上表中选择并写出一个能生成不溶物,且属于中和反应的化学方程式
Ba(OH)2+H2SO4═BaSO4↓+2H2O
Ba(OH)2+H2SO4═BaSO4↓+2H2O
.分析:(1)根据表中单元格的意义,完成表中的空格所对应物质的化学式;
(2)利用溶解性表,查出指定物质的溶解性;
(3)根据盐酸和硫酸与氧化铁反应的原理书写方程式,注意铁元素的化合价;
(4)根据复分解反应的条件分析;
(5)利用溶解性表,查找不溶的盐,完成化学方程式的书写.
(2)利用溶解性表,查出指定物质的溶解性;
(3)根据盐酸和硫酸与氧化铁反应的原理书写方程式,注意铁元素的化合价;
(4)根据复分解反应的条件分析;
(5)利用溶解性表,查找不溶的盐,完成化学方程式的书写.
解答:解:(1)空格为氢氧根与氢离子的交点,因此此格内的物质为水;
故答案为:H2O;
(2)查找硫酸钙的溶解性,硫酸根与钙离子相交的格内写着“微”,即硫酸钙微溶于水;
故答案为:微溶;
(3)盐酸和氧化铁反应产生氯化铁和水,硫酸和氧化铁反应产生硫酸铁和水,反应的方程式分别为:6HCl+Fe2O3═2FeCl3+3H2O;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
故答案为:6HCl+Fe2O3═2FeCl3+3H2O;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(4)氯化钡和硫酸钠相互交换成分能够产生硫酸钡沉淀,因此能够反应,反应的方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl;
故答案为:能;BaCl2+Na2SO4═BaSO4↓+2NaCl;
(5)中和反应生成盐和水,溶解性表中不溶性的盐只有硫酸钡,所以反应为:硫酸与氢氧化钡反应;
故答案为:H2SO4+Ba(OH)2═BaSO4↓+2H2O;
故答案为:H2O;
(2)查找硫酸钙的溶解性,硫酸根与钙离子相交的格内写着“微”,即硫酸钙微溶于水;
故答案为:微溶;
(3)盐酸和氧化铁反应产生氯化铁和水,硫酸和氧化铁反应产生硫酸铁和水,反应的方程式分别为:6HCl+Fe2O3═2FeCl3+3H2O;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
故答案为:6HCl+Fe2O3═2FeCl3+3H2O;Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;
(4)氯化钡和硫酸钠相互交换成分能够产生硫酸钡沉淀,因此能够反应,反应的方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl;
故答案为:能;BaCl2+Na2SO4═BaSO4↓+2NaCl;
(5)中和反应生成盐和水,溶解性表中不溶性的盐只有硫酸钡,所以反应为:硫酸与氢氧化钡反应;
故答案为:H2SO4+Ba(OH)2═BaSO4↓+2H2O;
点评:本题考查了常见的酸碱盐的溶解性以及复分解反应的条件,完成此题,可以依据相关的知识进行分析,能够理解在溶解性表中,“溶”字表示物质可溶;“不”字表示所对应物质不溶于水;“挥”字表示物质有挥发性等的意义.

练习册系列答案
相关题目
如表列出了部分酸、碱、盐在20℃时的溶解性.利用此表完成下列问题:
| 离子 | OH- | Cl- | 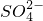 |
| H+ | 溶、挥 | 溶 | |
| Na+ | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 微 |
| Ba2+ | 溶 | 溶 | 不 |
(2)查:CaSO4的溶解性______;
(3)工业上常用表格中的两种酸(HCl或H2SO4)除铁锈(铁锈的主要成分是Fe2O3),该反应的化学方程式是(只要求写出其中一个,如果两个都写,且正确可另加2分,但全卷总分不超过100分):______、______;
(4)BaCl2、Na2SO4这两种盐溶液能否发生反应?如果能,请写出化学方程式;如果不能,请简要地说明理由.答:______;
(5)从上表中选择并写出一个能生成不溶物,且属于中和反应的化学方程式______.
酸、碱、盐溶解性表是学习自然科学的重要工具,如表列出了部分酸、碱、盐在20℃时的溶解性.”请利用此表完成
下列任务:
(1)查Cu(OH)2的溶解性(填“溶”或“不溶”)
(2)用化学方程式表示铁与表中的一种酸溶液和一种盐溶液的反应:.
| OH- | Cl- | CO32- | SO42- | |
| H+ | 溶 | 溶 | 溶 | |
| NH4+ | 溶 | 溶 | 溶 | 溶 |
| Zn2+ | 不 | 溶 | 不 | 溶 |
| Cu2+ | 不 | 溶 | 不 | 溶 |
(1)查Cu(OH)2的溶解性(填“溶”或“不溶”)
(2)用化学方程式表示铁与表中的一种酸溶液和一种盐溶液的反应:.
