题目内容
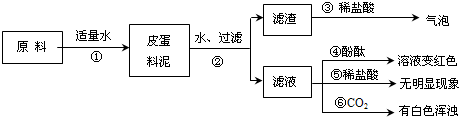
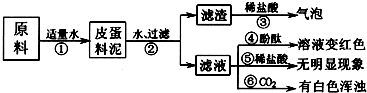
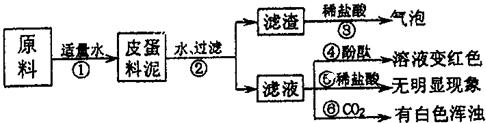
松花皮蛋是我们喜爱的食品,某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、食盐等.同学们对料泥进行了如下探究:探究一:料泥的主要成份
| 实验步骤 | 实验现象 | 实验结论 |
| 1、将皮蛋料泥的原料放入烧杯中,加适量的水搅拌、充分反应 | 试管外壁______,有白色沉淀生成 | 滤渣中一定有 ______. |
| 2、将上述烧杯中的物质过滤、洗涤,滤渣中滴加稀盐酸 | 有气泡冒出 | |
| 3、取少量滤渣于试管中加水充分溶解,取上层清液滴加______ | 上层清液由无色变成红色 | |
| 4、取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体 | 溶液变红色、无明显现象、有白色浑浊 | 滤液中的溶质一定有______ |
(1)请写出步骤①发生反应的化学方程式:______;______.
(2)由上述实验现象推断,料泥的主要成份是______.
探究二:测定料泥的原料中生石灰的含量(假设每步都能反应完全)
查阅资料:CaCO3+CO2+H2O=Ca(HCO3)2
实验步骤:
1.称得料泥原料的样品28g,放入烧杯中,加适量的水搅拌、充分反应.
2.向其中通入过量的CO2,过滤,洗涤干燥后称得滤渣为5g
回答下列问题:
(1)通入过量的CO2原因是______.
(2)利用测得的数据计算出料泥原料中生石灰的质量分数(要求写出计算过程).
思考:上述实验方案______(填合理或不合理).如不合理,原因是______;求出的值______(填偏大或偏小).
CaO+H2O=Ca(OH)2;CaCO3+2HCl=CaCl2+H2O+CO2↑
应用:你认为应该如何食用松花蛋?______,原因是______.
【答案】分析:探究一:生石灰与水反应放热;滤渣中滴加稀盐酸有气泡冒出,说明含有碳酸钙,取少量滤渣于试管中加水充分溶解,根据现象上层清液由无色变成红色,说明滴加的是无色酚酞,该步骤是检验氢氧化钙的存在;取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体,溶液变红色、无明显现象、有白色浑浊,说明滤液中含有氢氧化钙,和由碳酸钠和氢氧化钙反应生成的氢氧化钠;
(1)根据氧化钙和水、碳酸钠和氢氧化钙的反应原理书写方程式;
(2)通过实验可知料泥的成分;
探究二:(1)依据实验目的测定料泥的原料中生石灰的含量,观察实验步骤可知是通过测定生成沉淀的质量计算氢氧化钙、并进而计算氧化钙的质量,故要通入过量的二氧化碳;
(2)根据生成沉淀的质量结合方程式进行计算;
思考:根据所给资料可知实验方案不合理,可能有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙,从而使测量值偏小;
应用:根据料泥的成分,分析食用方法,并明确原因.
解答:解:探究一:根据制皮蛋料泥的原料可知生石灰与水反应放热,生成氢氧化钙;滤渣中滴加稀盐酸有气泡冒出,说明氢氧化钙与碳酸钠反应生成碳酸钙沉淀,取少量滤渣于试管中加水充分溶解,根据现象上层清液由无色变成红色,说明滴加的是无色酚酞,该步骤是检验氢氧化钙的存在;取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体,溶液变红色、无明显现象、有白色浑浊,说明滤液中含有氢氧化钙,和由碳酸钠和氢氧化钙反应生成的氢氧化钠;
(1)氧化钙和水反应生成氢氧化钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式分别是CaO+H2O═Ca(OH)2、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)通过以上实验及题目所给信息可知料泥的主要成份是NaOH、NaCl、CaCO3、Ca(OH)2;
探究二:(1)通入过量的CO2原因是将氢氧化钙完全转变为碳酸钙沉淀,使计算结果更准确;
(2)设料泥的原料中生石灰的质量为x
由CaO+H2O═Ca(OH)2,CO2+Ca(OH)2=CaCO3↓+H2O得:
CaO~CaCO3
56 100
x 5g
 =
= 解得x=2.8g
解得x=2.8g
所以料泥中生石灰的质量分数为: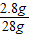 ×100%=10%
×100%=10%
答:料泥原料中生石灰的质量分数是10%;
思考:根据所给资料CaCO3+CO2+H2O=Ca(HCO3)2,可知实验方案不合理,可能会有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙,从而使测量值偏小;
应用:根据上述分析,制作过程中料泥的原料相互反应使其呈碱性,成分有NaOH、NaCl、CaCO3、Ca(OH)2,所以食用时可蘸食醋食用,反应部分碱;
故答案为:探究一:
(1)CaO+H2O═Ca(OH)2;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)NaOH、NaCl、CaCO3、Ca(OH)2;
探究二、
(1)将氢氧化钙完全转变为碳酸钙沉淀;
(2)10%;
思考:不合理;可能有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙;
应用:蘸食醋食用;制作过程中生成碱性物质使其呈碱性.
点评:本题考查知识综合,有一定的难度,要依据物质的性质结合实验现象、目的等认真分析解答,能很好的考查学生分析和解决问题的能力.
(1)根据氧化钙和水、碳酸钠和氢氧化钙的反应原理书写方程式;
(2)通过实验可知料泥的成分;
探究二:(1)依据实验目的测定料泥的原料中生石灰的含量,观察实验步骤可知是通过测定生成沉淀的质量计算氢氧化钙、并进而计算氧化钙的质量,故要通入过量的二氧化碳;
(2)根据生成沉淀的质量结合方程式进行计算;
思考:根据所给资料可知实验方案不合理,可能有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙,从而使测量值偏小;
应用:根据料泥的成分,分析食用方法,并明确原因.
解答:解:探究一:根据制皮蛋料泥的原料可知生石灰与水反应放热,生成氢氧化钙;滤渣中滴加稀盐酸有气泡冒出,说明氢氧化钙与碳酸钠反应生成碳酸钙沉淀,取少量滤渣于试管中加水充分溶解,根据现象上层清液由无色变成红色,说明滴加的是无色酚酞,该步骤是检验氢氧化钙的存在;取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体,溶液变红色、无明显现象、有白色浑浊,说明滤液中含有氢氧化钙,和由碳酸钠和氢氧化钙反应生成的氢氧化钠;
(1)氧化钙和水反应生成氢氧化钙,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,方程式分别是CaO+H2O═Ca(OH)2、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)通过以上实验及题目所给信息可知料泥的主要成份是NaOH、NaCl、CaCO3、Ca(OH)2;
探究二:(1)通入过量的CO2原因是将氢氧化钙完全转变为碳酸钙沉淀,使计算结果更准确;
(2)设料泥的原料中生石灰的质量为x
由CaO+H2O═Ca(OH)2,CO2+Ca(OH)2=CaCO3↓+H2O得:
CaO~CaCO3
56 100
x 5g
 =
= 解得x=2.8g
解得x=2.8g所以料泥中生石灰的质量分数为:
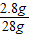 ×100%=10%
×100%=10%答:料泥原料中生石灰的质量分数是10%;
思考:根据所给资料CaCO3+CO2+H2O=Ca(HCO3)2,可知实验方案不合理,可能会有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙,从而使测量值偏小;
应用:根据上述分析,制作过程中料泥的原料相互反应使其呈碱性,成分有NaOH、NaCl、CaCO3、Ca(OH)2,所以食用时可蘸食醋食用,反应部分碱;
故答案为:探究一:
| 实验步骤 | 实验现象 | 实验结论 |
| 1、将皮蛋料泥的原料放入烧杯中,加适量的水搅拌、充分反应 | 试管外壁 发热,有白色沉淀生成 | 滤渣中一定有 CaCO3、Ca(OH)2. |
| 2、将上述烧杯中的物质过滤、洗涤,滤渣中滴加稀盐酸 | 有气泡冒出 | |
| 3、取少量滤渣于试管中加水充分溶解,取上层清液滴加 酚酞试液 | 上层清液由无色变成红色 | |
| 4、取滤液三份,分别滴加酚酞、稀盐酸和通入CO2气体 | 溶液变红色、无明显现象、有白色浑浊 | 滤液中的溶质一定有 Ca(OH)2、NaOH |
(2)NaOH、NaCl、CaCO3、Ca(OH)2;
探究二、
(1)将氢氧化钙完全转变为碳酸钙沉淀;
(2)10%;
思考:不合理;可能有部分碳酸钙被通入的过量的二氧化碳转变成了可溶于水的碳酸氢钙;
应用:蘸食醋食用;制作过程中生成碱性物质使其呈碱性.
点评:本题考查知识综合,有一定的难度,要依据物质的性质结合实验现象、目的等认真分析解答,能很好的考查学生分析和解决问题的能力.

练习册系列答案
相关题目
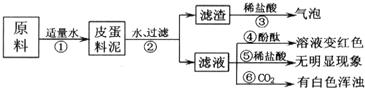 27、松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等.同学们把原料按一定比例混合就形成料泥,并对料泥进行了如下探究:
27、松花皮蛋是我们喜爱的食品.某小组同学查阅资料得知,制皮蛋料泥的原料主要是:生石灰、纯碱、草木灰(含K2CO3)等.同学们把原料按一定比例混合就形成料泥,并对料泥进行了如下探究: