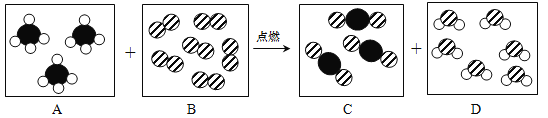
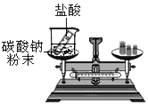
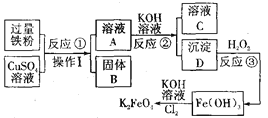
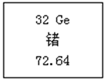题目内容
【题目】某饮用矿泉水1000g中的成分如图所示。
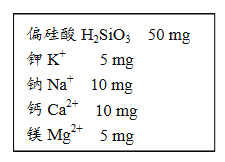
(1)此矿泉水中至少含有 种元素。
(2)在偏硅酸H2SiO3中,氢元素与氧元素的质量比为 。
(3)在偏硅酸H2SiO3中,求算硅元素的质量分数的计算式为 。
(4)某同学喝了500 g该矿泉水,他同时摄入的钾元素的质量为 mg。
【答案】(1)7(2)1:24(3)![]() (4)2.5
(4)2.5
【解析】
试题分析:从表格中看:同时含有偏硅酸H2SiO3、钾K+、钠Na+,钙Ca2+、镁Mg2+,所以此矿泉水中至少含有7种元素,在偏硅酸H2SiO3中,氢元素与氧元素的质量比为=1*2:16*3=1:24。在偏硅酸H2SiO3中,求算硅元素的质量分数的计算式为![]() ;500g该矿泉水,他同时摄入的钾元素的质量为=500克/1000克*5mg=2.5mg。
;500g该矿泉水,他同时摄入的钾元素的质量为=500克/1000克*5mg=2.5mg。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
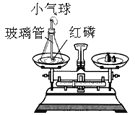
小学生10分钟应用题系列答案【题目】为了探究化学反应前后各物质的总质量是否发生改变,甲、乙、丙三组同学分别进行了下列实验,请根据图示回答问题。
[实验探究]甲、乙、丙三组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | 丙组 | |
实验装置 |
|
|
|
⑴甲组同学的实验现象是红磷燃烧,产生大量_______;小气球先膨胀,冷却后变得更瘪;反应后冷却到室温称量,天平的指针_______(填:“向右”、“向左”或“不”)偏转。在该实验中,玻璃管上系一个小气球的目的是________。该反应的化学方程式为_______。
⑵乙组同学的实验现象是铁钉表面有红色固体析出,溶液变为________色,反应前、后天平保持平衡。该反应的化学方程式为________。
⑶丙组同学的实验现象是反应剧烈,产生大量气泡,反应后天平不保持平衡。
[实验结论]化学反应前后各物质的总质量不发生改变。
[实验反思]在探究化学反应前后各物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在________装置中进行。