题目内容
【题目】某化学小组同学,用如图所示实验探究质量守恒定律.
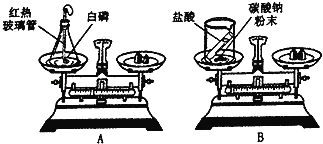
(1)充分反应冷却后,天平仍然平衡的是 (填写字母序号),该反应的化学方程式为 .
(2)由上述实验可知,在化学反应前后,一定不变的 (填数字序号).
①原子种类 ②原子数目 ③分子种类 ④分子数目 ⑤元素种类 ⑥物质总质量
(3)红热的铁能与水蒸气反应,放出气体X,同时生成固体Y.X气体靠近火焰点火时,能燃烧或发出爆鸣声.其反应的化学方程式为:3Fe+4H2O![]() 4X+Y.则X的化学式为 ,Y的化学式为 .
4X+Y.则X的化学式为 ,Y的化学式为 .
【答案】(1)A;4P+5O2![]() 2P2O5.
2P2O5.
(2)①②⑤⑥.
(3)H2;Fe3O4.
【解析】
试题分析:(1)白磷燃烧生成五氧化二磷,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳;
(2)化学反应前后,元素的种类不变,原子的种类、总个数不变;
(3)根据质量守恒定律可以判断物质的化学式.
解:(1)两个反应都遵循质量守恒定律,因为碳酸钠和稀盐酸反应生成的二氧化碳逸出进入空气中,所以B不平衡,A平衡;
白磷燃烧的化学方程式为:4P+5O2![]() 2P2O5.
2P2O5.
故填:A;4P+5O2![]() 2P2O5.
2P2O5.
(2)在化学反应前后,
①原子种类一定不变;
②原子数目一定不变;
③分子种类一定改变;
④分子数目可能改变,也可能不改变;
⑤元素种类一定不变;
⑥物质质量一定不变.
故填:①②⑤⑥.
(3)X气体靠近火焰点火时,能燃烧或发出爆鸣声,说明X是氢气,由3Fe+4H2O![]() 4H2+Y可知,氢原子反应前后个数相等,Y中应该含有3个铁原子和4个氧原子,是四氧化三铁,化学式是Fe3O4.
4H2+Y可知,氢原子反应前后个数相等,Y中应该含有3个铁原子和4个氧原子,是四氧化三铁,化学式是Fe3O4.
故填:H2;Fe3O4.

 名校课堂系列答案
名校课堂系列答案【题目】空气中氧气含量测定的再认识.
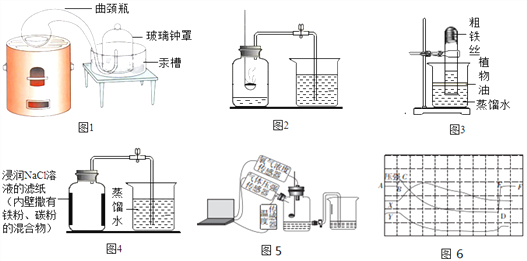
(1)【经典赏析】拉瓦锡用定量的方法研究空气的成分(实验装置如图1).
该实验中选择使用汞的优点有 ____________
A.实验过程中没有污染
B.能将密闭装置内空气中的氧气几乎耗尽
C.在汞槽中起到液封的作用
D.生成的化合物加热分解又能得到汞和氧气
(2)【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的符号表达式________________。图2中集气瓶底部的水的作用为_________。(填字母)
A.吸收有害物质 B.降温,快速冷却 C.保护瓶底
但是用该方法测出的氧气含量常常低于21%。
(3)【提出问题】用该方法测出的氧气含量为什么低于21%?
【进行猜想】①____________;②____________,装置内氧气有剩余;
(4)【实验与交流】为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师利用传感器技术定时测定了实验装置(如图5)内的压强、温度和氧气浓度,三条曲线变化趋势如图6所示。其中X曲线表示的是_____(填“温度”或“氧气的浓度”);
【反思拓展】结合X、Y两条曲线,解释如图6中BC段气压变化的原因是_______________;
(5)【实验探究1】已知,铁丝在纯氧中才能燃烧,反应的符号表达式为________________,一般不能在空气中燃烧,因此无法用铁丝代替红磷进行该实验。小明根据铁生锈的原理(铁在常温下可以和氧气、水生成铁锈)来测定空气中氧气的含量,于是进行了实验(装置如图3)。通过7天测得的数据计算出空气中氧气的含量为19.13%。
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法的主要优点____(填字母)。
A.装置内残留的氧气更少
B.反应更彻底,实验结果更准确
C.铁丝生锈比红磷燃烧反应更快
(6)【实验探究2】小明利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4)。8分钟后测得的数据如下表:请计算出空气中氧气含量________(计算结果保留一位小数)。相对于实验探究1,实验探究2改进的目的是_______________________。
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.6mL |
(7) 【拓展延伸】铜能与空气中氧气、水、二氧化碳反应生成铜绿[其主要成分为:
Cu2(OH)2CO3]。若将图3中的铁丝换成足量的铜丝,能否比较准确地测定空气中氧气的含量_____________,理由____________(填字母)
A.空气中CO2含量只有约0.03%,铜不能将装置内的氧气几乎耗尽
B.铜丝反应比铁丝快
C.反应更彻底