题目内容
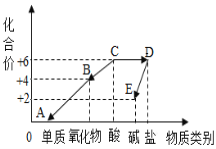
【题目】如图是a、b、c三种金属在相同条件下与相同浓度的盐酸反应的图象,试回答:
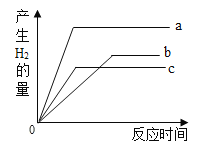
(1)a、b、c三种金属的活泼性顺序是:___________________
(2)已知b和c两金属的化合价相同,若b是铁,则c可能是(填序号)________。
A铝 B锌 C镁
(3)写出b(铁)与盐酸反应所对应的的离子方程式_____________。
【答案】a>c>b B ![]()
【解析】
(1)a、b、c三种金属在相同条件下与相同浓度的盐酸反应,a最先完成反应,其次为c,b最后完成反应,根据金属活动性顺序,可知三种金属的活泼性顺序是:a>c>b;
(2)b和c两金属的化合价相同,且c的活泼性大于b,则c可能为锌或镁,由图像可知,b金属产生氢气的量大于c金属,设b、c金属的质量为m,铁与稀盐酸反应生成氢气的质量为x,锌与稀盐酸反应生成氢气的质量为y,镁与稀盐酸反应生成氢气的质量为z,
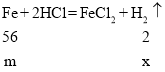
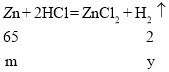
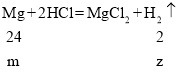
![]()
![]()
![]()
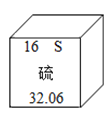
x=m/28 y=2m/65 z=m/12
故若b是铁,则c可能是锌。
故选B。
(3)b(铁)与盐酸反应所对应的的离子方程式:![]()

 能力评价系列答案
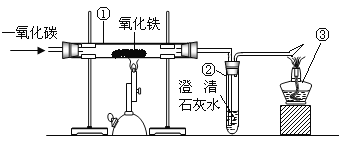
能力评价系列答案【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组用以下装置进行研究:

【查阅资料】I . 碎瓷片能防爆沸,碱石灰能作干燥剂。II. 氢气的化学性质与一氧化碳相似。
III. 铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引。
【推断】(1)观察到D中黑色固体变红,则B中生成的气体是____________。
(2)探究B装置中剩余固体成分是什么?
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe和Fe3O4 猜想二:剩余固体是___________。
【实验探究】
实验操作 | 实验现象 | 结论 |
取样,加入______(填试剂) | _________ | 猜想一正确 |
【实验结论】铁与水蒸气反应的化学方程式为_______,该反应为_________(填基本反应类型)。
【含量测定】取B装置中剩余黑色固体5g,与足量的CO反应后,所得固体质量为4.36 g,则原剩余黑色固体中Fe3O4的质量分数为___________。