题目内容
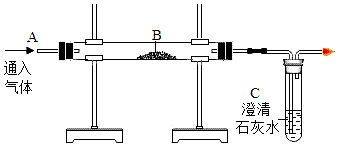
【题目】在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体。某兴趣小组用以下装置进行研究:
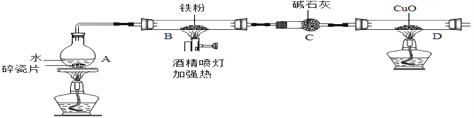
【查阅资料】I . 碎瓷片能防爆沸,碱石灰能作干燥剂。II. 氢气的化学性质与一氧化碳相似。
III. 铁的氧化物中,只有Fe2O3是红棕色,其余均为黑色,只有Fe3O4能被磁铁吸引。
【推断】(1)观察到D中黑色固体变红,则B中生成的气体是____________。
(2)探究B装置中剩余固体成分是什么?
【初步探究】B装置中剩余固体为黑色,能全部被磁铁吸引
【猜想与假设】
猜想一:剩余固体是Fe和Fe3O4 猜想二:剩余固体是___________。
【实验探究】
实验操作 | 实验现象 | 结论 |
取样,加入______(填试剂) | _________ | 猜想一正确 |
【实验结论】铁与水蒸气反应的化学方程式为_______,该反应为_________(填基本反应类型)。
【含量测定】取B装置中剩余黑色固体5g,与足量的CO反应后,所得固体质量为4.36 g,则原剩余黑色固体中Fe3O4的质量分数为___________。
【答案】 H2 Fe3O4 加稀盐酸 有气泡产生 3Fe+4H2O![]() Fe3O4+4H2 置换反应 46.4%
Fe3O4+4H2 置换反应 46.4%
【解析】【推断】观察到D中黑色固体变红,则B中生成的气体具有还原性,再根据反应物为“铁与水蒸气”,所以该气体是氢气;【猜想与假设】能被磁铁吸引的只有Fe与Fe3O4,则猜想一Fe3O4;又不可能只有Fe没有其他反应产物,猜想二是Fe与Fe3O4;验证猜想一与猜想二,关键是否含有Fe;【实验探究】根据铁与稀盐酸反应产生气体,进行设计实验:取少量黑色固体于试管中,加入足量的稀盐酸,若固体全部溶解,没有气泡冒出,则猜想一正确;若固体全部溶解,有气泡冒出,则猜想二正确,故填:取少量黑色固体于试管中,加入足量的稀盐酸;若固体全部溶解,没有气泡冒出,则猜想一正确.若固体全部溶解,有气泡冒出,则猜想二正确;【实验结论】根据“在高温下,铁与水蒸气能发生反应生成一种常见的铁的氧化物和一种气体”和猜想,所以铁和水蒸气反应会生成四氧化三铁和氢气,化学方程式为:3Fe+4H2O![]() Fe3O4+4H2;此反应属于置换反应;【含量测定】设黑色固体中四氧化三铁的质量为x,则
Fe3O4+4H2;此反应属于置换反应;【含量测定】设黑色固体中四氧化三铁的质量为x,则
Fe3O4-----3Fe 质量减少
232 168 64
x 5g-4.36g=0.64g
![]()
x=2.32g
原剩余黑色固体中Fe3O4的质量分数为: ![]() = 46.4%。
= 46.4%。