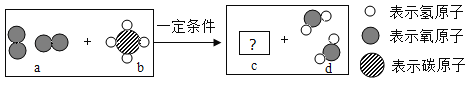
题目内容
【题目】水、溶液与人们的生产生活密切相关。请回答下列问题:
(1)硬水是指水中含有较多钙离子和镁离子的水,请写出钙离子的离子符号______。
(2)ClO2是饮用水常用的消毒剂,制取ClO2的化学方程式为:Cl2+2NaClO2=2ClO2+2X,X的化学式为______。
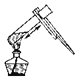
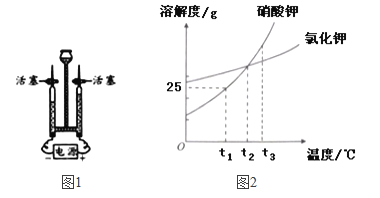
(3)图1为电解水的实验装置图,与正极相连的玻璃管内得到的气体是______。
(4)硝酸钾和氯化钾的溶解度曲线如图2所示:
①t1℃时,将25g硝酸钾加入到50g水中,充分溶解后,所得溶液的质量为______g。
②将t3℃时硝酸钾和氯化钾的饱和溶液各100g,降温至t2℃,过滤,得到溶液a和溶液b。
(5)对于溶液a和溶液b,下列说法正确的是______(选填序号)。
A 都是饱和溶液 B 溶液质量a<b C 溶质质量a=b D 溶剂质量a<b E 溶质的质量分数a=b
【答案】Ca2+ NaCl 氧气(或O2) 62.5 ABDE
【解析】
离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,化学反应前后,元素种类不变,原子个数不变,水在通电的条件下生成氢气和氧气,正氧负氢,体积比是1:2。
(1)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,若表示多个该离子,就在其离子符号前加上相应的数字,所以钙离子的离子符号是:Ca2+。
(2)化学反应前后,元素种类不变,原子个数不变,反应物中有4个氯原子、2个钠原子、4个氧原子,生成物中有2个氯原子、4个氧原子,所以X是NaCl。
(3)水在通电的条件下生成氢气和氧气,正氧负氢,体积比是1:2,所以与正极相连的玻璃管内得到的气体是氧气。
(4)① t1℃时,硝酸钾对应的溶解度是25g,所以将25g硝酸钾加入到50g水中,充分溶解后,所得溶液的质量为62.5g。
② 硝酸钾、氯化钾的溶解度随温度降低而减小,t2℃时,硝酸钾、氯化钾的溶解度相等,将t3℃时硝酸钾和氯化钾的饱和溶液各100g,然后降温至t2℃,过滤,得到溶液a和溶液b。对于溶液a和溶液b,所以
A、都是饱和溶液,故A正确;
B、t3℃时,氯化钾的溶解度小于硝酸钾的溶解度,氯化钾溶解度减小的幅度小于硝酸钾,所以硝酸钾析出晶体质量较大,所以溶液质量a<b,故B正确;
C、t3℃时,硝酸钾和氯化钾的饱和溶液各100g,氯化钾的溶解度小于硝酸钾的溶解度,所以溶质质量不相等,降低温度析出晶体后,得到溶液中的溶质质量不相等,故C不正确;
D.、t3℃时,氯化钾的溶解度小于硝酸钾的溶解度,硝酸钾和氯化钾的饱和溶液各100g,b溶液中的溶剂多,降低温度,不会影响溶剂的质量,所以溶剂质量a<b,故D正确;
E、A.b都是t2℃时的饱和溶液,所以溶质的质量分数a=b,故E正确。 故选ABDE。