题目内容
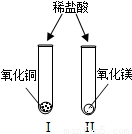
(2009?太原)为了解金属氧化物的性质,实验小组的同学们做了如图所示两个实验,请你和他们一起进行探究.(1)设计实验I、II提出的猜想是______;
(2)试管中加入稀盐酸,振荡,两种金属氧化物全部溶解.依据盐酸除铁锈的反应原理,实验II的试管中发生反应的化学方程式是______;
(3)稀盐酸中除含水分子外,还有HCl解离出的H+和Cl-.已知两种金属氧化物均不溶于水,为证实是H+溶解了金属氧化物,还是Cl-溶解了金属氧化物,可另取两支试管分别装入两种金属氧化物,然后再各向其中加入______(填化学式)溶液,你选择该物质的理由是______.
【答案】分析:金属氧化物可以与酸反应生成盐和水,要设计实验证明是氢离子还是氯离子使氧化物溶解,设计实验时需要排除另一种离子的干扰.
解答:解:(1)根据图示可知,氧化铜和氧化镁都属于金属氧化物,向这两种物质中加入的是盐酸,想探究的问题就是金属氧化物能否与酸反应,所以本题答案为:金属氧化物与酸(或盐酸)反应[或CuO、MgO能与酸(或盐酸)反应];
(2)氧化镁可以与盐酸发生复分解反应,生成氯化镁和水,所以本题答案为:MgO+2HCl=MgCl2+H2O;
(3)要设计实验证明是氢离子还是氯离子使氧化物溶解,设计实验时需要排除另一种离子的干扰,可以采用选用的物质都含有同一种离子,采用归纳的方法,从而得出结论,所以本题答案为:H2SO4(或HNO3)盐酸和硫酸(或硝酸)溶液中都含有H+,若加入硫酸(或硝酸)溶液金属氧化物溶解,则证实是H+溶解了金属氧化物.
[或NaCl(或KCl)盐酸和氯化钠(或氯化钾)溶液中都含有Cl-,若加入氯化钠(或氯化钾)溶液金属氧化物不溶解,则证实不是Cl-溶解了金属氧化物,而是H+溶解了金属氧化物]
[需答清三点:①二种溶液中都存在H+(或Cl-);②金属氧化物是否溶解;③说明是H+溶解了金属氧化物(或不是Cl-溶解了金属氧化物).除此之外均不得分]
点评:本题通过氧化铜和氧化镁与盐酸的反应,探究了金属氧化物与酸的反应,在设计实验证明是氢离子使金属氧化物溶解的实验中,采用了归纳的方法,另外在设计实验时要排除其他离子的干扰.
解答:解:(1)根据图示可知,氧化铜和氧化镁都属于金属氧化物,向这两种物质中加入的是盐酸,想探究的问题就是金属氧化物能否与酸反应,所以本题答案为:金属氧化物与酸(或盐酸)反应[或CuO、MgO能与酸(或盐酸)反应];
(2)氧化镁可以与盐酸发生复分解反应,生成氯化镁和水,所以本题答案为:MgO+2HCl=MgCl2+H2O;
(3)要设计实验证明是氢离子还是氯离子使氧化物溶解,设计实验时需要排除另一种离子的干扰,可以采用选用的物质都含有同一种离子,采用归纳的方法,从而得出结论,所以本题答案为:H2SO4(或HNO3)盐酸和硫酸(或硝酸)溶液中都含有H+,若加入硫酸(或硝酸)溶液金属氧化物溶解,则证实是H+溶解了金属氧化物.
[或NaCl(或KCl)盐酸和氯化钠(或氯化钾)溶液中都含有Cl-,若加入氯化钠(或氯化钾)溶液金属氧化物不溶解,则证实不是Cl-溶解了金属氧化物,而是H+溶解了金属氧化物]
[需答清三点:①二种溶液中都存在H+(或Cl-);②金属氧化物是否溶解;③说明是H+溶解了金属氧化物(或不是Cl-溶解了金属氧化物).除此之外均不得分]
点评:本题通过氧化铜和氧化镁与盐酸的反应,探究了金属氧化物与酸的反应,在设计实验证明是氢离子使金属氧化物溶解的实验中,采用了归纳的方法,另外在设计实验时要排除其他离子的干扰.

练习册系列答案
相关题目
 (2009?太原)为了解金属氧化物的性质,实验小组的同学们做了如图所示两个实验,请你和他们一起进行探究.
(2009?太原)为了解金属氧化物的性质,实验小组的同学们做了如图所示两个实验,请你和他们一起进行探究. (2009?太原)无土栽培是现代农业栽培植物的一种方法.无土栽培的植物从营养液中吸取养料和水分.
(2009?太原)无土栽培是现代农业栽培植物的一种方法.无土栽培的植物从营养液中吸取养料和水分.