��Ŀ����
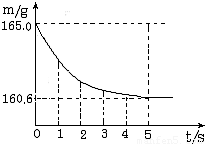
���ձ��м����Ȼ��ƺ�̼�����ƵĹ�������10.0g���ټ���68.9gϡ����ǡ����ȫ��Ӧ����Ӧ�����þ�����������ձ���ͬҩƷ����������m���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ���ձ���ͬҩƷ����ʼ������Ϊ165.0g����Ӧ�ķ���ʽΪ��NaHCO3+HCl�TNaCl+H2O+CO2���Իش��������⣺
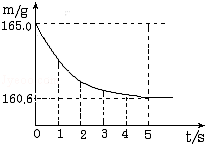
��1����ȫ��Ӧʱ����������̼������Ϊ�� ��g
��2��ԭ��������Ȼ��Ƶ�������
��3����Ӧ�������Ȼ�����Һ����������������
��1��4.4����2����ԭ��������Ȼ��Ƶ�����Ϊ1.6g��3���𣺷�Ӧ�������Ȼ�����Һ����������������10%��
��������
��������� ��1�����������غ㶨�ɣ���Ӧ���ɶ�����̼���������=165.0g��160.6g=4.4 g
��2����ԭ�������̼�����Ƶ�����Ϊx�������Ȼ��Ƶ�����Ϊy
NaHCO3+HCl=NaCl+H2O+CO2��
84 58.5 44
x y 4.4g
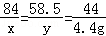
��֮�ã�x=8.4g��y=5.85g
����ԭ��������Ȼ��Ƶ�����Ϊ10.0g��8.4g=1.6g
��2����Ӧ��������Һ����=68.9 g+10.0g��4.4g=74.5g
��Ӧ��������Һ��������������=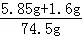 ��100%=10%
��100%=10%
�𣺷�Ӧ��������Һ��������������10%��
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ��㣻�й��������������ļ��㣮

| �������ʵ����� | 1 | 2 | 3 | 4 |
| ��������������Һ������/g | 25 | 25 | 25 | 25 |
| ���ɳ���������/g | 2.9 | X | 8.7 | 8.7 |
��2������20g����������Ʒ���Ȼ�þ��������

��3����������ʵ�������õ�������������Һ����������������
b�����ձ��м����Ȼ��ƺ�̼�����ƵĹ�������10.0g���ټ���68.9gϡ����ǡ����ȫ��Ӧ��
��Ӧ�������þ�����������ձ���ͬҩƷ����������m���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ���ձ���ͬҩƷ����ʼ������Ϊ165.0g����Ӧ�ķ���ʽΪNaHCO3+HCl=NaCl+H2O+CO2��������
��1����ȫ��Ӧʱ����������̼��������
��2������ԭ��������Ȼ��Ƶ�������
��3������ϡ�������������������
| �������ʵ����� | 1 | 2 | 3 | 4 |
| ��������������Һ������/g | 25 | 25 | 25 | 25 |
| ���ɳ���������/g | 2.9 | X | 8.7 | 8.7 |
��2������20g����������Ʒ���Ȼ�þ��������
��3����������ʵ�������õ�������������Һ����������������
b�����ձ��м����Ȼ��ƺ�̼�����ƵĹ�������10.0g���ټ���68.9gϡ����ǡ����ȫ��Ӧ��
��Ӧ�������þ�����������ձ���ͬҩƷ����������m���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ���ձ���ͬҩƷ����ʼ������Ϊ165.0g����Ӧ�ķ���ʽΪNaHCO3+HCl=NaCl+H2O+CO2��������
��1����ȫ��Ӧʱ����������̼��������______��
��2������ԭ��������Ȼ��Ƶ�������
��3������ϡ�������������������

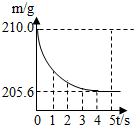 ���ձ��м����Ȼ��ƺ�̼���ƵĹ�������10.9g���ټ���113.5gϡ����ǡ����ȫ��Ӧ����Ӧ�����þ�����������ձ���ͬҩƷ����������m���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��
���ձ��м����Ȼ��ƺ�̼���ƵĹ�������10.9g���ټ���113.5gϡ����ǡ����ȫ��Ӧ����Ӧ�����þ�����������ձ���ͬҩƷ����������m���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��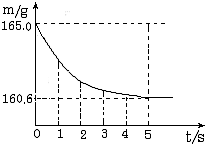 ��2005?�����ձ��м����Ȼ��ƺ�̼�����ƵĹ�������10.0g���ټ���68.9gϡ����ǡ����ȫ��Ӧ����Ӧ�����þ�����������ձ���ͬҩƷ����������m���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ���ձ���ͬҩƷ����ʼ������Ϊ165.0g����Ӧ�ķ���ʽΪ��NaHCO3+HCl�TNaCl+H2O+CO2���Իش��������⣺
��2005?�����ձ��м����Ȼ��ƺ�̼�����ƵĹ�������10.0g���ټ���68.9gϡ����ǡ����ȫ��Ӧ����Ӧ�����þ�����������ձ���ͬҩƷ����������m���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ���ձ���ͬҩƷ����ʼ������Ϊ165.0g����Ӧ�ķ���ʽΪ��NaHCO3+HCl�TNaCl+H2O+CO2���Իش��������⣺