��Ŀ����
����Ŀ��������ͼ��ʾ��ʵ����̺����ṩ�����ݻش����⡣������ǡ����ȫ��Ӧ��C�������ɵ�����ȫ���ݳ���
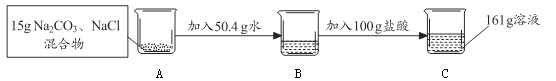
��֪��������Ӧ�Ļ�ѧ����ʽΪNa2CO3+2HCl=2NaCl+CO2��+H2O
�����ش�
��1��ˮ��H2O�������У��⡢��Ԫ�ص�ԭ�Ӹ�����Ϊ ��
��2����Ӧ����CO2������Ϊ g��
��3����������ϡ���������������������Ҫ��д��������̣�
��4����ȡC��Һ10 g���Ƴ�20������Һ�������30�����Ȼ�����Һ���ٿˣ�
��Ҫ��д��������̣�
���𰸡���1��2�U1 ��2��4.4;��3��7.3%. ��4��10g
��������
�����������1��ˮ��H2O�������У��⡢��Ԫ�ص�ԭ�Ӹ�����ΪԪ�ط������½ǵĽDZ�֮��2�U1
��2�����������غ㶨�ɿ�֪��Ӧ����CO2������Ϊ��15g+50.4g+100g-161g=4.4g
��3���⣺��μӷ�Ӧ��HCl����Ϊx��Na2CO3����Ϊy������NaCl����Ϊz
Na2 CO3 + 2HCl = 2NaCl + H2O+ CO2��
106 73 117 44
y x z 4.4g
![]()
y=10.6g x=7.3g z=11.7g
����ϡ�����������������![]()
��ϡ�����������������Ϊ7.3%.
��4���⣺![]()
������30%���Ȼ�����Һ����Ϊm
10��10%+m��30%=��10+ m����20%
m =10g
��������30%���Ȼ�����Һ����Ϊ10g��

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�����Ŀ����һ���ܱ������м����������ʣ���һ�������³�ַ�Ӧ����÷�Ӧǰ������ʵ��������±���
���� | �� | �� | �� | �� |
��Ӧǰ����/g | 3 | 5 | 20 | 7 |
��Ӧ������/g | 10 | 5 | 8 | ���� |
ͨ���������ж�����˵����ȷ����
A����÷�Ӧ�����ʵ�����Ϊ12g B��������һ���Ǵ���
C���÷�Ӧ�ǻ��Ϸ�Ӧ D���÷�Ӧ�мס�����������Ϊ5:4