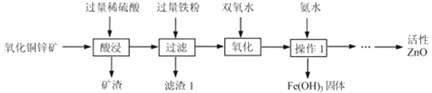
题目内容
【题目】为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
样品编号 | ① | ② | ③ | ④ |
稀盐酸的质量 | 25g | 50g | m(80<m<150) | 150g |
剩余固体的质量 | 7.5g | 5g | 2g | 2g |
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的 ![]() 于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为 .
(2)编号③所用稀盐酸的质量m为g.
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)
【答案】
(1)80%
(2)100
(3)
氯化钙与碳酸钠生成氯化钠的质量为b,生成碳酸钙沉淀的质量为c
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
20g×10.6% c b
![]()
c=2g
b=2.34g
所以A点处对应的溶液中溶质的质量分数是![]()
![]() ×100%=9.8%.
×100%=9.8%.
答:A点处对应的溶液中溶质的质量分数是9.8%.
【解析】解:(1)该石灰石样品的纯度为 ![]() ×100%=80%;
×100%=80%;
2)依据①中的数据进行计算,
设盐酸的质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
2.5g x×25g![]() =
= ![]()
x=7.3%
设编号③所用稀盐酸的质量为y,生成二氧化碳质量为z,生成氯化钙质量为a
CaCO3+2HCl = CaCl2+H2O+CO2↑
100 73 111 44
8g y×7.3% a z![]() =
= ![]() =
= ![]() =
= ![]()
y=80g
z=3.52g
a=8.88g
碳酸钠消耗的盐酸质量为m,生成氯化钠质量为n,生成二氧化碳质量为d
Na2CO3 + 2HCl = 2NaCl+H2O+CO2↑
106 73 117 44
5g×10.6% m×7.3% n d![]() =
= ![]() =
= ![]() =
= ![]()
m=5g
n=0.585g
d=0.22g
所以编号③所用稀盐酸的质量m为80g+4×5g=100g;
3)氯化钙与碳酸钠生成氯化钠的质量为b,生成碳酸钙沉淀的质量为c
CaCl2+Na2CO3=CaCO3↓+2NaCl
111 106 100 117
20g×10.6% c b![]() =
= ![]() =
= ![]()
c=2g
b=2.34g
所以A点处对应的溶液中溶质的质量分数是: ![]() ×100%=9.8%.
×100%=9.8%.
所以答案是:(1)80%;(2)100g;(3)A点处对应的溶液中溶质的质量分数是9.8%.
【考点精析】根据题目的已知条件,利用根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握各物质间质量比=系数×相对分子质量之比.