题目内容
归纳是学习的重要方法,小红在复习盐酸的性质时,归纳出盐酸的五条化学性质.(1)为了验证性质①,小红将紫色石蕊溶液滴加到盐酸溶液中,溶液变 色.
(2)盐酸的性质④决定了用熟石灰改良酸性土壤,该反应的化学方程式是 .
(3)为了验证性质⑤,可选用的物质是 (填一种即可).
(4)镁和锌可以用来验证盐酸的性质②,小红要探究镁和锌与盐酸反应的快慢,需要控制不变(相同)的量 (填序号).
A.两种金属的形状 B.盐酸的质量分数 C.反应容器的大小 D.温度
(5)等质量的锌和镁分别与足量的同种盐酸充分反应,产生氢气较多的是 .
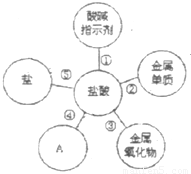
【答案】分析:(1)利用石蕊遇酸的变色情况分析即可.
(2)综合分析酸的化学性质可对A的类别进行判断并书写方程式.
(3)根据盐与盐酸反应的条件进行分析判断.
(4)控制变量法就是创设相同的外部条件,并对所比较的量进行分析..
(5)依据金属和酸反应生成氢气的质量关系分析解答;
解答:解:(1)石蕊遇酸性溶液会变红色,所以将紫色石蕊试液滴加到盐酸溶液中溶液变红.
(2)盐酸的性质④决定了用熟石灰改良酸性土壤,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O;
(3)酸与盐的反应一定要符合复分解反应的发生条件,所以选择的盐与盐酸反应时一定会有水、气体或沉淀生成.所以该盐可以是硝酸银;
(4)控制变量法就是创设相同的外部条件,因此探究镁和锌与盐酸反应的快慢,需要控制不变的条件就是对反应速度可能有影响的因素,分析知四个因素中只有容器的大小对反应速度无影响.
(5)金属与足量的酸反应生成氢气的质量为:金属的质量× ,而锌和镁分别为65、24,故生成的氢气镁较多;
,而锌和镁分别为65、24,故生成的氢气镁较多;
故答案为:(1)红;(2)Ca(OH)2+2HCl=CaCl2+2H2O;(3)AgNO3;(4)ABD;(5)镁;
点评:熟练掌握酸的化学性质与酸碱盐之间的反应规律是解答本题的关键.
(2)综合分析酸的化学性质可对A的类别进行判断并书写方程式.
(3)根据盐与盐酸反应的条件进行分析判断.
(4)控制变量法就是创设相同的外部条件,并对所比较的量进行分析..
(5)依据金属和酸反应生成氢气的质量关系分析解答;
解答:解:(1)石蕊遇酸性溶液会变红色,所以将紫色石蕊试液滴加到盐酸溶液中溶液变红.
(2)盐酸的性质④决定了用熟石灰改良酸性土壤,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O;
(3)酸与盐的反应一定要符合复分解反应的发生条件,所以选择的盐与盐酸反应时一定会有水、气体或沉淀生成.所以该盐可以是硝酸银;
(4)控制变量法就是创设相同的外部条件,因此探究镁和锌与盐酸反应的快慢,需要控制不变的条件就是对反应速度可能有影响的因素,分析知四个因素中只有容器的大小对反应速度无影响.
(5)金属与足量的酸反应生成氢气的质量为:金属的质量×
 ,而锌和镁分别为65、24,故生成的氢气镁较多;
,而锌和镁分别为65、24,故生成的氢气镁较多;故答案为:(1)红;(2)Ca(OH)2+2HCl=CaCl2+2H2O;(3)AgNO3;(4)ABD;(5)镁;
点评:熟练掌握酸的化学性质与酸碱盐之间的反应规律是解答本题的关键.

练习册系列答案
相关题目
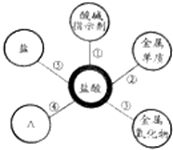 归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互反应).
归纳是学习的重要方法,小红在复习盐酸的性质时归纳出盐酸的五条化学性质(如图所示,连线表示相互反应). (2011?芜湖)归纳是学习的重要方法,小红在复习盐酸的性质时,归纳出盐酸的五条化学性质(如右图所示,连线表示相互反应).
(2011?芜湖)归纳是学习的重要方法,小红在复习盐酸的性质时,归纳出盐酸的五条化学性质(如右图所示,连线表示相互反应). 归纳是学习的重要方法,小红在复习盐酸的性质时,归纳出盐酸的五条化学性质.
归纳是学习的重要方法,小红在复习盐酸的性质时,归纳出盐酸的五条化学性质.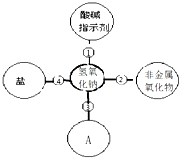 归纳是学习的重要方法,小红在复习氢氧化钠的性质时归纳出氢氧化钠的四条化学性质(如图所示,连线表示相互反应).
归纳是学习的重要方法,小红在复习氢氧化钠的性质时归纳出氢氧化钠的四条化学性质(如图所示,连线表示相互反应).