题目内容
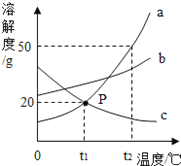
【题目】科学家采用“组合转化”技术,可将二氧化碳在一定条件下转化为重要的化工原料乙烯,
其反应的微观过程如图所示。下列说法不正确的是

A. 乙烯属于氧化物
B. 反应前后原子种类、数目均不变
C. 该反应中分子可分,原子不可分
D. 参加反应的两种分子的个数比是1:3
【答案】A
【解析】据微观示意图可知:CO2和H2在条件下转化为化工原料乙烯(C2H4)和水,配平即可,故其化学方程式为:2CO2+6H2 ![]() C2H4+4H2O,因此:
C2H4+4H2O,因此:
A、乙烯的化学式为C2H4,由碳、氢两种元素组成,不属于氧化物,故说法错误;
B、根据质量守恒定律及微观示意图,可知反应前后原子种类、数目均不变,故说法正确;
C、化学变化是分子分成原子,原子重新构成分子的过程,故说法正确;
D、参加反应的两种分子的个数比是2:6=1:3,故说法错误。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】地球上的金属资源广泛地存在于地壳和海洋中。
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
冶炼方法 | 主要原理 | 代表金属 |
电解法 | 熔融的金属化合物在通电的条件下分解 | 钠、铝 |
热还原法 | 金属氧化物与一氧化碳(或碳等)在高温的条件下反应 | 铁、铜 |
热分解法 | 金属氧化物在加热的条件下分解 | 汞、银 |
(1)利用金属活泼性的不同,可以采用不同的冶炼方法。
①电解熔融的氯化镁可以得到镁。分别写出氯化镁和镁的化学式,并标出其中镁元素的化合价:___________、___________。
②炼铁的原理是利用一氧化碳和氧化铁的反应,写出该反应的化学方程式:_________________________。
③二百多年前,拉瓦锡研究空气的成分时,加热红色的氧化汞粉末得到了银白色的汞,写出该反应的化学方程式:_______________________。
④从含有铅元素并有开采价值的矿石中提取铅,应选择上述方法中的_______________。
(2)某工厂利用废铁屑与废硫酸反应制取硫酸亚铁。现有废硫酸9.8 t(硫酸的质量分数为20%),与足量的废铁屑反应,可生产硫酸亚铁的质量是多少?(写出计算过程)____________