��Ŀ����
����Ŀ��ʵ��������������Ϊ15%��˫��ˮ��H2O2����ȡ������װ�ü�ͼ��ʱ�����ַ�Ӧ�ٶ�̫�죬���������ռ�������ѧ��ȤС���о����֣���ȡ����ʱֻҪȡһ������������˫��ˮ���ټ�����ͬ������ˮ���л�ϣ�����ʹ������Ӧ�Ƚ�ƽ�������ܿ��������ȡ������������ռ�����ش��������⣺

��1������ȤС���о����֣���H2O2��ȡ����ʱ��H2O2��Һ������������ÿ����� %���ң�
��2��д����H2O2��ȡ�����Ļ�ѧ����ʽ ��
��3��MnO2��������ˮ�Ĺ����ĩ����H2O2��������Ӧ�Ĵ�����ʵ�������ɲ��� �ķ��������Ի������ã�
���𰸡���1��7.5����2��2H2O2![]() 2H2O+O2������3�����ˣ�
2H2O+O2������3�����ˣ�
��������
�����������1�������������������ļ��㹫ʽ���㲢�ش�
��2�����ݹ��������������ķ�Ӧԭ���ش�
��3�����ݹ�������������ʱ�IJ�����ɷ֡����ʼ����˵�ԭ�������÷�Χ�ش�
��1����ԭ��Һ������ΪX
��X��15%=��X+X����y
y=7.5%
��H2O2��Һ������������ÿ�����7.5%���ң�
��2�����������ڶ��������������������·ֽ�����ˮ������������ʽΪ��2H2O2![]() 2H2O+O2����
2H2O+O2����
��3�����������ڶ��������������������·ֽ�����ˮ����������Ӧ��IJ�����Ϊˮ�Ͷ������̣��Ҷ������̲��ܽ���ˮ�������Ƿ��������Һ��IJ������ʿ�ͨ�����˰Ѷ������̷��������
�ʴ�Ϊ����1��7.5����2��2H2O2![]() 2H2O+O2������3�����ˣ�
2H2O+O2������3�����ˣ�

 �����������һ��һ��ϵ�д�
�����������һ��һ��ϵ�д�����Ŀ��������һЩ��������ʵ���о�����Ҫ����ա�
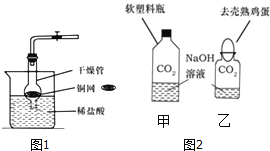
��1��ģ�ҵ����(װ��ͼ����ͼ)����Ӳ�ʲ������ڼ���������������ĩ����ͨ��һ����̼���ų�װ���ڿ��������þƾ���Ƽ���A��ҩƷ��
�� Ӳ�ʲ������ڷ�����Ӧ�Ļ�ѧ����ʽΪ�� ��
�� �Թ�B�з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
�� ��װ������Ҫȱ���� ��
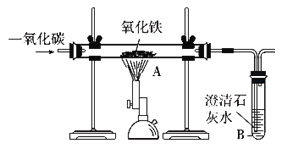
��2������ʴ��̽��
ij��ѧ��ȤС����м�ͥ��ѧʵ����̽������ʴ��ԭ�������������ͼ��ʾ������Ԥ���ʵ�����ǽ���ͼ���е��������⡣������һ��ʱ��Ĺ۲죬���Ƿ�����֧�Թ��������������ˡ�
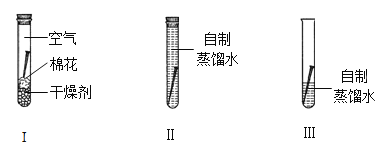
��ʦ����ȡ��ͬѧ�㱨����������ʵ�����ͬѧ����ԭ��ȡ4�ݵ�������ˮ����������ͬ�ķ��������������ִ������ⶨˮ���е��ܽ���������������ͼ(����������)��ʵ����
ˮ���ܽ����������£�
����ˮ | 1��ˮ�� | 2��ˮ�� | 3��ˮ�� | 4��ˮ�� |
�������� | ������ | ��� �ܷ�Ѹ����ȴ | ��� �ܷ���Ȼ��ȴ | ��� ������ȴ |
�ܽ���(mg/L) | 5.37 | 0.52 | 0.66 | 3.44 |
[��ʦʵ��������¼(����)]��2��ˮ�����е���ͼ����ʵ���У�һ������������������ӵڶ��쵽�����죬���ⲻ�����ӡ�
�ο��������ݷ�������ѧ��ʵ���У�ͼ�������������ԭ������� ��
ͼ�������������ԭ������� ��
����ʦʵ������¼��ʵ�������ԭ������� ��