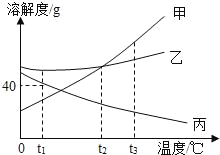
题目内容
t℃时,欲使一接近饱和的溶液变成饱和溶液,分别采取下列措施:
①降低温度,②降低溶解度,③加水,④加入足量的溶质。一定能达到目的的是( )
A.只有④ B.只有① C.①③ D.②④
 长江作业本同步练习册系列答案
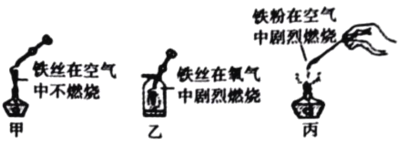
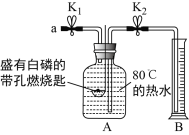
长江作业本同步练习册系列答案某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。(已知:白磷的着火点为40℃)
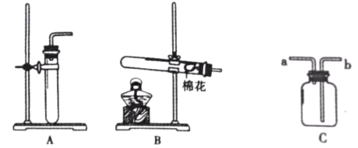
实验装置 | 实验步骤及现象 |
| 步骤Ⅰ.检查装置的气密性,气密性良好。 步骤Ⅱ.将盛有足量白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧 步骤Ⅲ.向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧。 步骤Ⅳ.打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧 |
(1) 通过步骤________可知可燃物燃烧的条件之一是要有氧气。
(2) 将装置冷却一段时间后,打开K2,如果观察到________,说明空气中氧气的体积约占1/5。若该实验测得空气中氧气的体积分数小于1/5,原因可能 是________。
碳酸钠、碳酸氢钠是生活中两种常见的重要的盐。
(1)碳酸钠(俗称纯碱、苏打)与碳酸氢钠(俗称_____),均为________色固体,水溶液均呈_______性,向它们的水溶液中分别滴入无色酚酞试液,酚酞试液均变红色。
(2)碳酸钠、碳酸氢钠均可与稀盐酸反应,其中碳酸钠与稀盐酸反应的化学方程式为_____。但是,碳酸钠、碳酸氢钠与稀盐酸反应产生二氧化碳的速率是否相同?校兴趣小组同学针对于此,展开探究:
(方案设计)
①甲设计的实验如图1所示,实验时,同时全部推出足量稀盐酸后,观察到图2所示现象。于是他得出______和稀盐酸反应产生二氧化碳较快的结论。

②乙同学通过计算可知:0.318 g碳酸氢钠约产生0.167 g二氧化碳,而0.318 g碳酸钠产生二氧化碳的质量为______g,等质量的碳酸钠与碳酸氢钠与足量的稀盐酸作用,碳酸氢钠产生二氧化碳的质量更多,显然甲同学的设计不妥,应取含碳元素质量相同的碳酸钠和碳酸氢钠进行实验。若碳酸钠的质量仍为0.318g,应称取碳酸氢钠的质量为_______g。
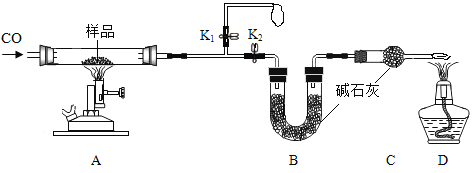
③小组同学在老师指导下设计了图3所示实验。连通管除消除稀盐酸滴入占有体积引起的误差,还有______的作用。
分别取等体积、含碳元素质量相同的碳酸钠和碳酸氢钠稀溶液(各滴2滴酚酞溶液)以及相同体积、相同浓度的足量稀盐酸进行实验。实验时,广口瓶内压强随时间变化如图4所示,溶液颜色变化记录如表1。

表1:
滴入酚酞溶液 | 滴入稀盐酸,溶液颜色变化 | |
碳酸钠溶液 | 红色 | 红色→浅红色→无色 |
碳酸氢钠溶液 | 浅红色 | 淺红色→无色 |
(实验结论)分析图4所示的实验数据可得到:相同条件下,碳酸氢钠与稀盐酸反应产生二氧化碳速率更快,你判断的理由是_______。
(实验反思)小组同学分析表1实验现象和图4数据,得出碳酸钠能与稀盐酸反应产生二氧化碳,反应是分步进行的。第一步发生的化学反应方程式是:_______,第二步发生的反应是:NaHCO3+HCl=NaCl+H2O+CO2↑。


 将水通电一段时间
将水通电一段时间 向一定量的硝酸银溶液中插入铜丝
向一定量的硝酸银溶液中插入铜丝 分别向等质量的锌、铁中滴加等质量分数的稀盐酸
分别向等质量的锌、铁中滴加等质量分数的稀盐酸 分别向等质量的溶质质量分数为15%、10%的 盐酸中不断加水
分别向等质量的溶质质量分数为15%、10%的 盐酸中不断加水