题目内容
为了测定实验室中氯酸钾样品的纯度,某小组取2.5克该样品与0.8克二氧化锰混合,(样品中的杂质不参与反应),称量剩余固体的质量随时间的变化如表所示,请仔细分析实验数据,回答以下问题:
(1)在 时间后,该样品中的氯酸钾已经完全反应;
(2)反应中生成氧气的质量是 ,剩余固体混合物中二氧化锰的质量为 ;
(3)求样品中氯酸钾的质量分数?
| 加热时间 | t1 | t2 | t3 | t4 |
| 剩余固体质量/g | 2.48 | 2.41 | 2.34 | 2.34 |
(2)反应中生成氧气的质量是
(3)求样品中氯酸钾的质量分数?
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)分析剩余固体随加热时间而变化的情况时,可发现,加热时间为t3和t4时剩余固体质量不变,说明加热时间为t3时氯酸钾已经完全分解;
(2)根据质量守恒定律,在反应剩余固体不再减小时,与原固体的质量差即为放出氧气的质量;二氧化锰作为反应中的催化剂,反应前后质量不变;
(3)根据反应的化学方程式,由放出氧气的质量计算出样品中氯酸钾的质量,再利用纯度公式计算该样品中氯酸钾的纯度.
(2)根据质量守恒定律,在反应剩余固体不再减小时,与原固体的质量差即为放出氧气的质量;二氧化锰作为反应中的催化剂,反应前后质量不变;
(3)根据反应的化学方程式,由放出氧气的质量计算出样品中氯酸钾的质量,再利用纯度公式计算该样品中氯酸钾的纯度.
解答:解:(1)分析剩余固体随加热时间而变化的情况,当加热至t3时剩余固体的质量不再减小,说明加热时间为t3时氯酸钾已经完全分解;
故填:t3;
(2)根据质量守恒定律,至固体质量不再减小,放出氧气的质量=2.5g+0.8g-2.34g=0.96g;
二氧化锰作为反应中的催化剂,反应前后质量不变,故为0.8g;
故填:0.96g,0.8g;
(3)设样品中氯酸钾的质量为x.
2KClO3
2KCl+3O2↑
245 96
x 0.96g
=
x=2.45 g
则该样品中氯酸钾的质量分数为=
×100%=98%
答:该样品中氯酸钾的质量分数为98%.
故填:t3;
(2)根据质量守恒定律,至固体质量不再减小,放出氧气的质量=2.5g+0.8g-2.34g=0.96g;
二氧化锰作为反应中的催化剂,反应前后质量不变,故为0.8g;
故填:0.96g,0.8g;
(3)设样品中氯酸钾的质量为x.
2KClO3
| ||
| △ |
245 96
x 0.96g
| 245 |
| 96 |
| x |
| 0.96g |
x=2.45 g
则该样品中氯酸钾的质量分数为=
| 2.45g |
| 2.5g |
答:该样品中氯酸钾的质量分数为98%.
点评:分析图表中数据时,要关注造成数据发生变化的原因,分析数据不再改变时所说明的问题,从而发现隐含条件.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
有X、Y、Z三种金属,将三种金属分别浸入稀硫酸中,Y溶解并放出氢气,X、Z不溶解;将X浸入Z的硫酸盐溶液中,在X的表面有Z析出.则三种金属的活动性由强到弱排列顺序正确的是( )
| A、X>Y>Z |
| B、Y>X>Z |
| C、Y>Z>X |
| D、X>Z>Y |
下列变化中属于化学变化的是( )
| A、氧气加压降温成淡蓝色液体 |
| B、轮胎爆炸 |
| C、木炭的吸附作用 |
| D、食物腐败 |

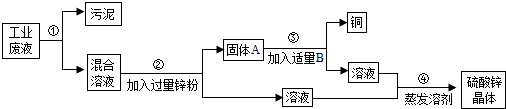
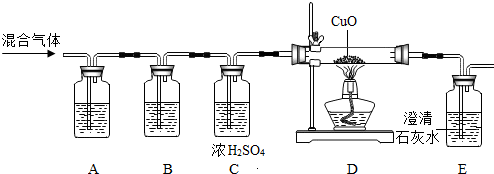

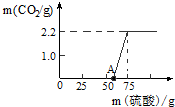 某校研究性学习小组进行了一个有趣的实验探究:
某校研究性学习小组进行了一个有趣的实验探究: