��Ŀ����
����Ŀ����������������������������أ�
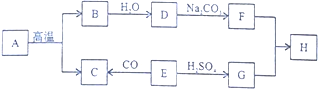
��1������ͭ���������ǹ㷺���õ����ֽ�����������ģ�������������ֽ������Ⱥ�˳�������� �����йأ�
A���ؿ��н����ĺ��� B�������Ļ�� C���������۵�
��2�����Ļ�Ա���ǿ������Ϊʲôȴ���ڿ�����ȴ���ֳ����õĿ���ʴ�ԣ�
��3��ij����������CuSO4��ZnSO4��FeSO4�ķ�Һ�������´��������йؽ����ͻ�����������ͼ����
����ͼ�����ͼ�ش�
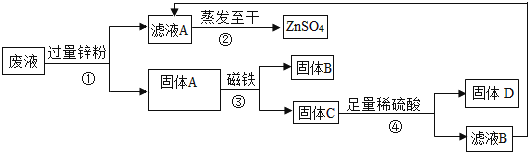
a������ٺ͢���Ҫ���еIJ���Ϊ ������A��һ���е�����Ϊ ��
b���������п�۱��������ԭ���� ��
c�����鲽����м����ϡ�����Ƿ������ķ����� ��
d����д��������з����Ļ�ѧ��Ӧ����ʽ ��
e����ȡ15g����C�����ձ��У������м���100gϡ���ᣬ����ǡ����ȫ��Ӧ����Ӧ����������ձ���ʣ�����ʵ�������Ϊ114.6g���������ձ���������������ܽ���Բ��ƣ����Լ���������Һ�����ʵ�����������
���𰸡���1��B����2��ͨ������£����ܺͿ����е�������Ӧ����һ�����ܵ������ﱡĤ����ֹ����һ����Ӧ����3��a�����ˣ�ͭ������п��b������Һ�е�Cu2+��Fe2+ȫ���û�������c��ȡ����ܵ��������Թ��У���������ϡ���ᣬ�������ݲ������������������������d��Zn+H2SO4=ZnSO4+H2����e��28.6%
��������
��1����Ԫ�ؿ������õ��Ⱥ�˳��ͽ������˳���йأ���ѡ��B��
��2�����ڿ�����ȴ���ֳ����õĿ���ʴ���ܣ���ԭ���ǣ�ͨ������£����ܺͿ����е�������Ӧ����һ�����ܵ������ﱡĤ����ֹ����һ����Ӧ��
��3��a������ٺܶ͢��ǽ������Һ��ֿ�������Ϊ���ˣ�п�����û�����ͭ�е�ͭ����������������Ӧ��������п����������п�۹���������п����ȫ�û�����ͭ�е�ͭ�����������е���������A��һ����ͭ������п��
b�����ݷ�Һ�гɷ�CuSO4��ZnSO4��FeSO4����֪���������п���ǰ�����п��Ӧ�����ʶ���Ӧ����п����������ͭ��Ӧ��п����������������Ӧ�����Բ������п�۱��������ԭ���ǽ���Һ�е�Cu2+��Fe2+ȫ���û�������
c��������м����ϡ������Ϊ�˺�п��Ӧ����Ҫ���Ƿ���û��Ӧ��п���У����Բ�����м����ϡ�����Ƿ������ķ����ǣ�ȡ����ܵ��������Թ��У���������ϡ���ᣬ�������ݲ������������������������
d������п�����ᷴӦ��������������������п��д������ʽ��Zn+H2SO4=ZnSO4+H2����
e����Ϊ��������������Ϊ15g+100g��114.6g=0.4g����
�����ɵ�����п������Ϊx���μӷ�Ӧ��п������Ϊy��
Zn+H2SO4=ZnSO4+H2��
65 161 2
y x 0.4g
��![]() �����x=32.2g��y=13g
�����x=32.2g��y=13g
������Һ�����ʵ���������Ϊ��![]() ��100%=28.6%��
��100%=28.6%��

����Ŀ��Ԫ��X��Y��Z��M�dz��л�ѧ����������Ԫ�أ��й���Ϣ�����
Ԫ�� | �й���Ϣ |
X | ���γ���Է���������С�����嵥�� |
Y | �γɵ�һ�ֵ�������Ȼ���ڵ���Ӳ������ |
Z | �䵥��Լռ��������� |
M | �����ں�����ߵĽ���Ԫ�� |
��1��MԪ�ص������� ��
��2��Y�γɵ���Ȼ���ڵ���Ӳ�������� �������ʲ����� ����л���������
��3����X��Y��Ԫ����ɵ�����л����� ���ѧʽ�������л�����XԪ�ص���������Ϊ ��
��4����Y��Z��Ԫ����ɵ��������˹�����Ĺ��������� ��
��5����Z��M��Ԫ�ذ�ԭ�Ӹ�����1��1��ɵĻ�����׳� ��д������ˮ��Ӧ�Ļ�ѧ����ʽ ��