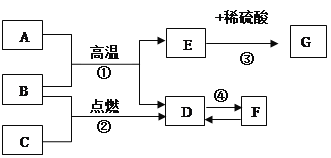
题目内容
【题目】在NaOH和Na2CO3的混合物9.3g中加入一定量的10.0%的稀盐酸,恰好完全反应,将生成的气体全部通入足量的澄清石灰水中,产生5.0g沉淀。下列说法正确的是
A. 反应共产生11.7gNaCl
B. 题中的一定量是7.3g
C. 如用10%的稀盐酸将5.0g沉淀溶解,则所用稀盐酸的量与题中的一定量相等
D. Na2CO3消耗的稀盐酸比NaOH消耗的稀盐酸多
【答案】A
【解析】根据生成碳酸钙的质量,可以求解碳酸钠与盐酸反应生成二氧化碳的质量,通过二氧化碳的质量可以求解碳酸钠与氯化氢的质量;混合物在氢氧化钠的质量=9.3g-碳酸钠的质量,进一步求解所需氯化氢的质量和生成氯化钠的质量。
解:设生成5.0g沉淀所需二氧化碳的质量为x。
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
44 100
X 5.0g
![]()
x=2.2g
设生成2.2g二氧化碳需要碳酸钠的质量为a,需要氯化氢的质量为b,生成氯化钠的质量为c。
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
106 73 117 44
a b c 2.2g
![]()
a=5.3g
b=3.65g
c=5.85g
混合物中氯化钠的质量=9.3g-5.3g=4.0g
设与氢氧化钠反应的氯化氢的质量为d,生成氯化钠的质量为e。
HCl + NaOH = NaCl + H2O
36.5 40 58.5
d 4.0g e
![]()
d=3.65g
e=5.58g
反应共产生NaCl的质量为5.58g+5.58g=11.7g,故正确;
题中的一定量是(3.65g+3.65g)![]() 10.0%=70g,故错误;
10.0%=70g,故错误;
C. 有方程式: Na2CO3+2HCl=2NaCl+H2O+CO2↑, CO2+Ca(OH)2=CaCO3↓+H2O, CaCO3+2HCl=CaCl2+H2O+CO2↑,可知2HCl![]() CO2
CO2![]() CaCO3
CaCO3![]() 2HCl,10%的稀盐酸将5.0g沉淀溶解,则所用稀盐酸的量与题中的与碳酸钠反应所需的量相等,故错误;
2HCl,10%的稀盐酸将5.0g沉淀溶解,则所用稀盐酸的量与题中的与碳酸钠反应所需的量相等,故错误;
D. 根据计算可知,Na2CO3消耗的稀盐酸与NaOH消耗的稀盐酸相等,故错误。
本题选A。

【题目】下列对一些事实的解释中,不合理的是( )
选项 | 事 实 | 解 释 |
A | 将品红加入一杯清水中,清水很快变红 | 分子在不断运动 |
B | 氢气可用向下排空气法收集 | 相同条件下氢气密度比空气小 |
C | CO2和N2都能使燃着的木条熄灭 | CO2和N2一般都不支持燃烧 |
D | 25 m的氧气可以装入0.024 m的钢瓶中 | 氧分子的体积变小 |
A. A B. B C. C D. D