题目内容
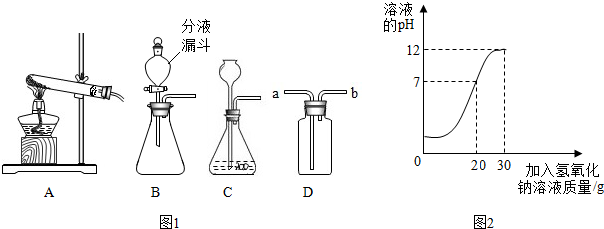
请回答下列有关化学实验的问题.如图1是实验室制取气体的装置图:
(1)A中的试管口为什么应略向下倾斜?
(2)如何检查C的气密性?制取气体时,与装置C相比,装置B有哪些优点?
(3)如何选用D装置,用排水法收集氧气,该如何操作?
(4)某同学在做氢氧化钠溶液和稀盐酸的酸碱中和反应,并对反应后的溶液成分进行探究.
【提出问题】反应后的溶液中含有哪些溶质?
【作出猜想】甲:NaCl,乙:NaCl、HCl 丙:NaCl、NaOH和HCl 丁:NaCl NaOH
【交流表达】甲、乙、丙中不合理的猜想及其原因是
取36.5g2%的盐酸,向其中逐渐加入氢氧化钠溶液,反应过程中溶液的pH值变化情况如图2所示.请计算氢氧化钠溶液中溶质的质量分数.
(1)A中的试管口为什么应略向下倾斜?
(2)如何检查C的气密性?制取气体时,与装置C相比,装置B有哪些优点?
(3)如何选用D装置,用排水法收集氧气,该如何操作?
(4)某同学在做氢氧化钠溶液和稀盐酸的酸碱中和反应,并对反应后的溶液成分进行探究.
【提出问题】反应后的溶液中含有哪些溶质?
【作出猜想】甲:NaCl,乙:NaCl、HCl 丙:NaCl、NaOH和HCl 丁:NaCl NaOH
【交流表达】甲、乙、丙中不合理的猜想及其原因是
| 实验步骤 | 现象及化学方程式 | 结论 |
| 取少量反应溶液于试管中 | 猜想乙正确 | |

考点:常用气体的发生装置和收集装置与选取方法,实验探究物质的组成成分以及含量,检查装置的气密性,制取氧气的操作步骤和注意点,中和反应及其应用,根据化学反应方程式的计算
专题:物质的分离、除杂、提纯与共存问题,科学探究
分析:A中的试管口应略向下倾斜的原因是:防止冷凝的水倒流热的试管底部,使试管炸裂;检查C的气密性的方法是:用弹簧夹夹住胶皮管,从长颈漏斗口加水,水面浸没长颈漏斗末端,若长颈漏斗内形成一段稳定的水柱或液面不再下降,表明装置气密性良好;与装置C相比,装置B的优点是:可以控制反应速率;选用D装置,用排水法收集氧气的方法是:向集气瓶内注满水,将氧气从b端进入,水从a端排出,因为氧气的密度比水小;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.甲、乙、丙中不合理的猜想丙,因为氢氧化钠和盐酸不能共存;实验步骤:取少量反应溶液于试管中,滴入碳酸钠溶液,现象是有气体放出,碳酸钠与盐酸反应生成氯化钠和水和二氧化碳,配平即可;根据化学方程式的计算要准确.
解答:解:(1)A中的试管口应略向下倾斜的原因是:防止冷凝的水倒流热的试管底部,使试管炸裂,故答案为:防止冷凝的水倒流热的试管底部,使试管炸裂;
(2)检查C的气密性的方法是:用弹簧夹夹住胶皮管,从长颈漏斗口加水,水面浸没长颈漏斗末端,若长颈漏斗内形成一段稳定的水柱或液面不再下降,表明装置气密性良好;与装置C相比,装置B的优点是:可以控制反应速率;故答案为:用弹簧夹夹住胶皮管,从长颈漏斗口加水,水面浸没长颈漏斗末端,若长颈漏斗内形成一段稳定的水柱或液面不再下降,表明装置气密性良好;可以控制反应速率;
(3)选用D装置,用排水法收集氧气的方法是:向集气瓶内注满水,将氧气从b端进入,水从a端排出,因为氧气的密度比水小;故答案为:向集气瓶内注满水,将氧气从b端进入,水从a端排出;
(4)甲、乙、丙中不合理的猜想丙,因为氢氧化钠和盐酸不能共存;实验步骤:取少量反应溶液于试管中,滴入碳酸钠溶液,现象是有气体放出,碳酸钠与盐酸反应生成氯化钠和水和二氧化碳,配平即可;故答案为:丙的猜想不合理,原因是氢氧化钠和盐酸不能共存;
实验步骤:滴入碳酸钠溶液;有气体放出;Na2CO3+2HCl=2NaCl+CO2↑+H2O;
解:设氢氧化钠溶液中溶质的质量为x,
NaOH+HCl=NaCl+H2O
40 36.5
x 36.5g×2%
=
x=0.8g;
氢氧化钠溶液中溶质的质量分数=
×100%=4%
答:氢氧化钠溶液中溶质的质量分数为4%.
故答案为:4%;
(2)检查C的气密性的方法是:用弹簧夹夹住胶皮管,从长颈漏斗口加水,水面浸没长颈漏斗末端,若长颈漏斗内形成一段稳定的水柱或液面不再下降,表明装置气密性良好;与装置C相比,装置B的优点是:可以控制反应速率;故答案为:用弹簧夹夹住胶皮管,从长颈漏斗口加水,水面浸没长颈漏斗末端,若长颈漏斗内形成一段稳定的水柱或液面不再下降,表明装置气密性良好;可以控制反应速率;
(3)选用D装置,用排水法收集氧气的方法是:向集气瓶内注满水,将氧气从b端进入,水从a端排出,因为氧气的密度比水小;故答案为:向集气瓶内注满水,将氧气从b端进入,水从a端排出;
(4)甲、乙、丙中不合理的猜想丙,因为氢氧化钠和盐酸不能共存;实验步骤:取少量反应溶液于试管中,滴入碳酸钠溶液,现象是有气体放出,碳酸钠与盐酸反应生成氯化钠和水和二氧化碳,配平即可;故答案为:丙的猜想不合理,原因是氢氧化钠和盐酸不能共存;
实验步骤:滴入碳酸钠溶液;有气体放出;Na2CO3+2HCl=2NaCl+CO2↑+H2O;
解:设氢氧化钠溶液中溶质的质量为x,
NaOH+HCl=NaCl+H2O
40 36.5
x 36.5g×2%
| 40 |
| 36.5 |
| x |
| 36.5g×2% |
氢氧化钠溶液中溶质的质量分数=
| 0.8g |
| 20g |
答:氢氧化钠溶液中溶质的质量分数为4%.
故答案为:4%;
点评:本考点主要考查了检查装置的气密性、注意事项、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、同种元素组成的物质就是单质 |
| B、含氧的化合物就是氧化物 |
| C、一种元素只能组成一种单质的说法是错误的 |
| D、化合物是由不同元素组成的物质 |
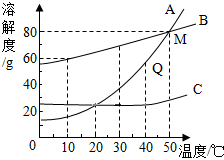 如图是A、B、C三种物质的溶解度曲线.据图,回答下列问题.
如图是A、B、C三种物质的溶解度曲线.据图,回答下列问题. ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,若它们构成的分子在一定条件下发生如图所示的变化.
”表示氧原子,若它们构成的分子在一定条件下发生如图所示的变化.