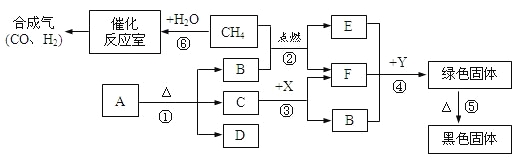
题目内容
【题目】将等质量的镁和铁分别放入等质量、相同质量分数的稀盐酸中,产生氢气的质量反应时间的关系如图所示,下列说法错误的是

A.反应结束后镁一定有剩余
B.反应消耗盐酸的总质量一定相等
C.0﹣t1时段,产生氢气的质量镁比铁大
D.0﹣t2时段,参加反应的镁的质量与铁相等
【答案】D
【解析】A.由图示可知,反应后生成的氢气质量相等,由反应方程式中各物质的质量比可知,反应中产生氢气质量相等时,消耗金属镁的质量少、铁的质量多,根据“等质量的镁粉和铁粉与酸反应”可知,镁一定剩余,故A说法正确;
B.由图可知生成的氢气质量是相等,则参加反应的盐酸的质量相等,故B说法正确;
C.由图可知,0﹣t1时段,产生氢气的质量曲线镁在铁的上方,即镁反应产生的氢气质量比铁的多,故C说法正确;
D.0﹣t2时段产生的氢气相等,而反应中生成氢气质量相等时,镁反应的质量少、铁反应的质量多,故D说法错误;故选D
试题分析:根据图示中生成氢气的质量相等,则消耗盐酸的质量一定相等;根据产生等质量的氢气时,消耗铁的质量大于镁的质量分析;根据图示可知0﹣t1时段镁反应产生氢气的质量大于铁.

练习册系列答案
相关题目