题目内容
【题目】通过对九年级化学这门功课的学习,我们学会物质的鉴别、检验、推断与计算.
(1)A~J都是初中化学中的常见物质,其中D、E对维持自然界生命活动至关重要.A、B为黑色固体,C、G都是金属单质,I为无色气体,它们的相互转化关系如图所示: 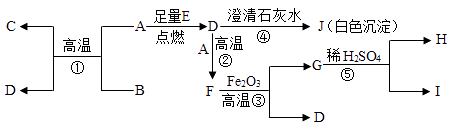
请回答:
写出下列物质的化学式:A .
反应①②③④⑤中属于置换反应的为(填序号).
写出反应②的化学方程式 , 其中为该反应的氧化剂.
写出反应⑤的化学方程式.
(2)某研究学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品20g,把80g稀盐酸分四次加入,实验过程所得数据如表格(已知石灰石样品中含有的二氧化硅等杂质不溶于水,不与稀盐酸反应).根据实验数据计算:(1)表中n的数值为 . (2)样品中碳酸钙的质量分数是 .
(3)求盐酸中溶质的质量分数.
实验次数 | 加入稀盐酸的质量/g | 剩余固体的质量/g |
1 | 20 | 15 |
2 | 20 | 10 |
3 | 20 | 6.8 |
4 | 20 | n |
【答案】
(1)C;①⑤;3CO+Fe2O3 ![]() 2Fe+3CO2;Fe2O3;Fe+HCl=FeCl2+H2↑.
2Fe+3CO2;Fe2O3;Fe+HCl=FeCl2+H2↑.
(2)6.8;66%
(3)由题分析20g稀盐酸恰好能与石灰石中的5g碳酸钙完全反应
设第一次参与反应的HCl质量为x,
CaCO3+ | 2HCl=CaCl2+H2O+CO2↑ |
100 | 73 |
5g | x |
![]()
解之得:x=3.65g,
盐酸中溶质的质量分数为: ![]() =18.25%.
=18.25%.
答:盐酸中溶质的质量分数为18.25%.
【解析】解:(1)A、B为黑色固体,C是红色金属单质,故A和B是碳和氧化铜的反应,C是铜,生成的D是二氧化碳,二氧化碳能使澄清的石灰水变浑浊,故J是碳酸钙,A是碳;E是氧气;二氧化碳能与碳高温反应生成一氧化碳,故F是一氧化碳;一氧化碳还原氧化铁高温反应生成铁和二氧化碳,故G是铁,铁与稀盐酸反应生成的H是氢气,故I是氯化亚铁,带入框图,推断合理;①、A是碳;故填:C;②、①是碳与氧化铜反应生成铜和二氧化碳,属于置换反应,②是碳与二氧化碳高温反应生成一氧化碳,属于化合反应,③一氧化碳与氧化铁高温反应生成二氧化碳和铁,不属于置换反应,④是二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,不属于基本反应类型,⑤是铁与稀盐酸反应生成氯化亚铁和氢气,属于置换反应, 故填:①⑤;
③、②是一氧化碳与氧化铁高温反应生成铁和二氧化碳,氧化铁在反应中失去了氧,发生了还原反应,是氧化剂.
故填:3CO+Fe2O3 ![]() 2Fe+3CO2;Fe2O3 . ④、反应⑤是铁与稀盐酸反应生成的H是氢气,化学方程式为:Fe+HCl=FeCl2+H2↑.
2Fe+3CO2;Fe2O3 . ④、反应⑤是铁与稀盐酸反应生成的H是氢气,化学方程式为:Fe+HCl=FeCl2+H2↑.
故填:Fe+HCl=FeCl2+H2↑.(2)①根据图表数据可知,第1、2次反应后固体物质减少的质量都为5g,而第3次反应后固体物质减少的质量为3.2g,说明此时碳酸钙已反应完,不再产生气体,故表中n的数值为6.8.
所以答案是:6.8.②样品中碳酸钙的质量分数= ![]() ×100%=66%.
×100%=66%.
所以答案是:66%.
【考点精析】根据题目的已知条件,利用根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握各物质间质量比=系数×相对分子质量之比.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】大理石是我市重要的矿产资源,其主要成分为碳酸钙,某化学小组为测定其中碳酸钙的含量,称取大理石样品50g,分成五等份至于5只烧杯中进行实验.实验数据见下表(假设大理石中其它成分均不参加反应,也不溶于水)
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入大理石样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 20 | 40 | 60 | 80 | 100 |
烧杯中剩余固体的质量/g | 8 | 6 | 4 | 2 | 2 |
求:
(1)样品中碳酸钙的质量分数是多少?
(2)所用盐酸的溶质质量分数是多少?