题目内容
【题目】一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量
与时间的关系如图所示,下列说法不正确的是
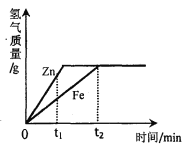
A.0-t1时段,产生氢气的质量锌比铁大
B.0-t1时段,产生氢气的速率锌比铁大
C.0-t2时段,参加反应的锌的质量与铁相同
D.0-t2时段,锌、铁消耗的盐酸质量相同
【答案】C
【解析】
试题分析:A、直接从图可以看出,0-t1时段,产生氢气的质量锌比铁大,正确,B、根据金属的活动性,锌的活动性比铁强,所以0-t1时段,产生氢气的速率锌比铁大,正确,C、因为0-t2时段,表示反应结束,最终产生氢气的质量相等,结合方程式:Zn + 2HCl = ZnCl2 + H2↑和Fe+2HCl = FeCl2 + H2↑,从中可以看出,要得到相同质量的氢气,参加反应的锌的质量与铁不相同,错误,D、根据C的分析,0-t2时段,产生氢气的质量相等,故锌、铁消耗的盐酸质量相同,正确,故选C

练习册系列答案
相关题目