题目内容
【题目】某同学为探究碱的性质,对氢氧化钙进行如下实验。
(1)将石蕊试液滴入澄清石灰水中,振荡,溶液呈____色。
(2)将稀盐酸逐滴加入含有酚酞试液的石灰水中,振荡,可观察到什么现象?____
(3)将CO2气体通入澄清石灰水中,澄清石灰水变浑浊,说明氢氧化钙能与某些___(填物质类别)反应,氢氧化钙与氢氧化钠的化学性质相似,试写出三氧化硫与氢氧化钠反应的化学方程式___。
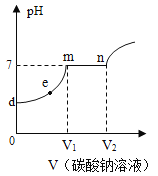
(4)向氢氧化钙和稀盐酸反应后的溶液中逐滴滴加Na2CO3溶液,溶液pH的变化如图所示,e点溶液中溶质的化学式是___,滴入Na2CO3溶液的过程中d~m段观察到的现象是____,m~n段观察到的现象是___。
(5)称取5g含有氯化钠杂质的氢氧化钠样品,加入25g水后充分溶解,缓慢加入10%的稀盐酸,当溶液的pH=7时,刚好用去稀盐酸的量为36.5g。计算样品中氢氧化钠的质量分数____。
【答案】蓝 溶液由红色逐渐变为无色 氧化物 SO3+2NaOH===Na2SO4+H2O CaCl2、HCl和NaCl 有气泡产生 有白色沉淀产生 80%
【解析】
(1)澄清的石灰水呈碱性,石蕊试液遇碱性物质变蓝色。将石蕊试液滴入澄清石灰水中,振荡,溶液呈蓝色;
(2)酚酞试液遇碱性物质变红色,遇酸性和中性不变色,呈无色。氢氧化钙与盐酸反应生成呈中性的氯化钙和水。将稀盐酸逐滴加入含有酚酞试液的石灰水中,振荡,可观察到溶液由红色逐渐变为无色;
(3)CO2是由两元素组成,其中一种元素是氧元素的化合物,属于氧化物,将CO2气体通入澄清石灰水中,澄清石灰水变浑浊,说明氢氧化钙能与某些氧化物反应,氢氧化钙与氢氧化钠的化学性质相似,三氧化硫与氢氧化钠反应生成硫酸钠和水,反应的化学方程式为:SO3+2NaOH===Na2SO4+H2O;
(4)向氢氧化钙和稀盐酸反应后的溶液中逐滴滴加Na2CO3溶液,溶液pH的变化如图所示,说明氢氧化钙和稀盐酸反应后的溶液中存在氯化钙和盐酸,当逐滴滴加Na2CO3溶液时,碳酸钠溶液先与盐酸反应,生成氯化钠、水和二氧化碳;当盐酸完全反应后,碳酸钠溶液与氯化钙反应生成碳酸钙和氯化钠。e点溶液pH小于7,说明加入的碳酸钠与溶液中的盐酸反应,盐酸有剩余,溶液中的溶质为CaCl2、NaCl、HCl;滴入Na2CO3溶液的过程中d~m段发生的反应是碳酸钠溶液先与盐酸反应,生成氯化钠、水和二氧化碳,观察到的现象是有气泡产生;m~n段发生的反应是碳酸钠溶液与氯化钙反应生成碳酸钙和氯化钠,观察到的现象是有白色沉淀产生;
(5)设:样品中NaOH的质量为x。
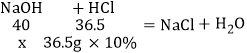
![]() x=4g
x=4g
样品中氢氧化钠的质量分数=![]() 。
。
答:样品中氢氧化钠的质量分数为80%。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】根据提供的实验装置回答问题。
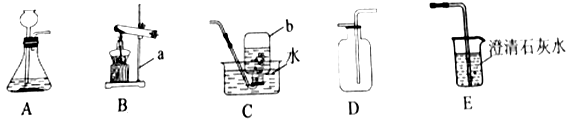
(1)写出实仪器名称:a为_______;b为__________。
(2)实验室用B装置制取O2,发生反应的化学方程式为__________。
(3)实验室制取CO2的发生和收集装置是________(填字母序号),CO2通过E装置可观察到的实验现象是____________。小明在实验中用C装置收集到一瓶CO2,为了弄清其中道理,他可采取的科学态度和方法是_______(填数字序号)。
①置之不理 ②查阅资料 ③交流讨论 ④请教老师
(4)CO2能与NaOH发生反应
【实验过程】检查装置气密性。如图所示连接好装置。进行实验。
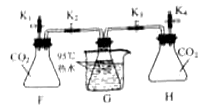
序号 | 操作步骤 | 实验现象 |
I | 打开弹簧夹K1,关闭弹簧夹K2、K3、K4,将20mL水注入锥形瓶F中,关闭弹簧夹K1,振荡瓶F,打开弹簧夹K2 | 无明显现象 |
II | 关闭弹簧夹K2,打开弹簧夹K4,将20mLNaOH溶液注入锥形瓶H中,关闭弹簧夹K4,振荡瓶H,打开弹簧夹K3 | 锥形瓶G中的热水剧烈沸腾 |
【实验分析】锥形瓶G中热水剧烈沸腾的原因是_____________。
【实验反思】有观点认为只需要进行实验操作Ⅱ,即可说明CO2与NaOH发生反应。你对该观点的看法是________(选填“赞同”或“不赞同”),理由是____________。