题目内容
【题目】如图,用下列实验操作可完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )
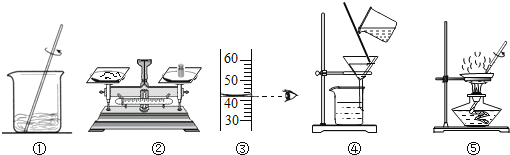
A.甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B.甲实验各步操作中,玻璃棒的作用都是相同的
C.乙实验若按照②③①的步骤进行操作,则配制的溶液浓度偏大(p水=1g/cm3)
D.乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
【答案】C
【解析】
试题分析:除去粗盐中难溶性杂质的步骤是:溶解、过滤、蒸发;
配制一定质量分数的溶液的步骤是:计算、称量、溶解.
解:A、其中去除杂质的关键步骤是过滤.不正确.
B、①中玻璃棒的作用是加快溶解,④中玻璃棒的作用是引流,⑤中玻璃棒的作用是防止液体溅出.不正确.
C、乙实验若按照②③①的步骤进行操作时,量筒中的水是42mL,质量为:1g/cm3×42mL=42g,砝码质量是5g,溶质质量分数为:![]() ×100%=10.6%,所以按照②③①的步骤进行操作,则配制的溶液浓度偏大.正确.
×100%=10.6%,所以按照②③①的步骤进行操作,则配制的溶液浓度偏大.正确.
D、乙实验中,若①所用的烧杯内壁沾有水时,溶质质量不变,当溶液中的溶剂质量增大时,质量分数减小,所以若①所用的烧杯内壁沾有水,对配制的溶液浓度有影响.不正确.
故选:C.

【题目】在校园科技节上,为测出鸡蛋壳(主要成分是碳酸钙)中钙元素的质量分数,某同学称取已洗净、晾干、研成粉末的鸡蛋壳10克置于烧杯中,将烧杯放在电子天平上,往烧杯中加入足量的稀盐酸,每0.5分钟记录一次电子天平的示数,据此计算出产生气体的质量,具体数据如表(反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑):
时间(分钟) | 0 | 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
产生气体质量(克) | 0 | 1.80 | 3.00 | 3.60 | 3.96 | 3.96 | 3.96 |
(1)若产生的气体全部是鸡蛋壳中的碳酸钙与盐酸反应生成的CO2,根据实验结果计算出该鸡蛋壳中钙元素的质量分数。(假定鸡蛋壳中其它成分不含钙元素,写出具体计算过程)
(2)下列哪些情况会导致实验中钙元素质量分数测量结果偏大? (可多选)
A.盐酸溶质质量分数过大 B.鸡蛋壳未晾干
C.鸡蛋壳中含有碳酸镁 D.鸡蛋壳未充分研碎
【题目】实验是科学探究的重要方法,如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题.
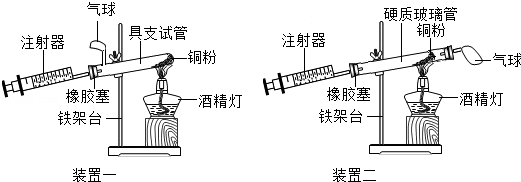
(1)根据下表提供的实验数据,完成下表.
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 9mL |
(2)装置一和装置二中气球的位置不同, (填“装置一”或“装置二”)更合理,理由是 .
(3)若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些?(列举两条) 、 .