题目内容
【题目】下图是小明配制100g溶质质量分数为12%的NaCl溶液的有关实验操作示意图。
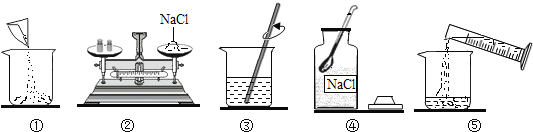
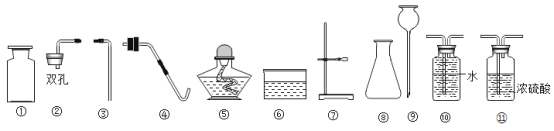
(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、________、_________、量筒。
(2)请你指出图中一处错误操作,并分析该操作可能造成的后果。________________________________________。
(3)图②、图③表示的操作步骤分别是________________。
(4)配制时需称量氯化钠____________g,如果氯化钠中含有少量不溶的杂质,溶质的质量分数会________________(填“偏大”或“偏小”);量取水最好选择______________的量筒(填序号①10mL②50mL③100mL)。(水的密度为1g/cm3)
【答案】烧杯 玻璃棒 图②中是砝码和药品的位置放反了,会造成所配溶液溶质质量分数偏小 称量和溶解 12 偏小 ③
【解析】
(1)配制过程使用的玻璃仪器分别是:广口瓶、烧杯、量筒、玻璃棒等;故填:烧杯;玻璃棒;
(2)用天平称量物质时要左物右码,而图②中却是左码右物,所称药品质量小于实际所需质量,会造成所配溶液溶质质量分数偏小;故填:图②中是砝码和药品的位置放反了,会造成所配溶液溶质质量分数偏小;
(3)图②、图③表示的操作分别是:称量和溶解;故填:称量和溶解;
(4)溶质的质量=溶液的质量×溶质的质量分数,为100g×12%=12g,溶剂水的质量为100g-12g=88g,通过密度可求算出水的体积为88mL,故选100mL的量筒;如果氯化钠中含有少量不溶的杂质,溶质质量分数会偏小;故填:12;偏小;③。

练习册系列答案
相关题目