题目内容
【题目】取Na2CO3和NaCl的混合物10g加入50g水中形成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl ),反应时CaCl2溶液与产生的沉淀的质量关系如图所示,请解决以下问题:
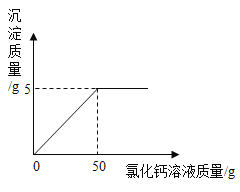
(l)计算原混合物中NaCl的质量_____。
(2)恰好反应完时所得溶液的溶质质量分数_____。
【答案】4.7克 10%
【解析】
(1)解:设样品中碳酸钠的质量为x,生成氯化钠的质量为y,

x=5.3g,y=5.85g
原混合物中NaCl的质量为10g-5.3g=4.7g
答:原混合物中NaCl的质量为4.7g。
(2)恰好反应完时所得溶液的溶质质量分数为:![]()
答:恰好反应完时所得溶液的溶质质量分数为10%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目