题目内容
为了测定某氢氧化钠固体是否含有碳酸钠(不含其他杂质),现用纯氢氧化钠与其对比进行对比实验如下:①称取纯氢氧化钠和待测氢氧化钠各mg分别配成25.0g溶液,均滴加酚酞2~3滴.②把12.0%的盐酸逐滴加入实验①配成的两种溶液中,当酚酞试液刚好由红色变为无色(溶液呈中性)时,纯氢氧化钠配成的溶液消耗盐酸n1g,待测氢氧化钠配成的溶液消耗盐酸n2g.
(1)若m=2.73g,n1=n2=20.8g,则待测氢氧化钠配成的溶液中NaOH 的质量分数是多少?
(2)若m=2.73g,n1=20.8g,n2=19.7g,则待测氢氧化钠配成的溶液中NaOH 的质量分数是多少?
解答:解:(1)因为纯氢氧化钠和待测氢氧化钠各mg,所用盐酸的质量n1=n2,则证明待测氢氧化钠中不含碳酸钠,则待测氢氧化钠配成的溶液中NaOH 的质量分数是
 ×100%=10.9%
×100%=10.9%(2)据题意n1>n2,可知待测氢氧化钠中含有碳酸钠.设NaOH的质量为x,Na2CO3的质量为(2.73-x),则有
NaOH+HCl=NaCl+H2O Na2CO3 +2HCl=2NaCl+H2O+CO2↑
40 36.5 106 73
x
 2.73-x
2.73-x 
 +
+ =19.7×12.0% 得x=2.16g
=19.7×12.0% 得x=2.16g则待测氢氧化钠溶液中溶质的质量分数为
 ×100%=8.64%
×100%=8.64%故答案为:(1)n1=n2时,不含Na2CO3,则有
 ×100%=10.9%
×100%=10.9%(2)n1>n2时,含Na2CO3,8.64%
点评:本题考查有关化学方程式的计算和溶质质量分数的计算以及利用化学方程式进行计算的能力,考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,难度较大.

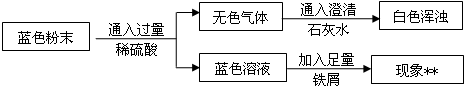
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组对固体沉淀的成分进行了如下探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①结晶水合物受热后易失去结晶水,如CuSO4?5H2O CuSO4 + 5H2O↑;
CuSO4 + 5H2O↑;
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
③无水氯化钙可做吸水剂;碱石灰的主要成分为氢氧化钠固体和氧化钙
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经 、洗涤、室温晾干得蓝色固体。
Ⅱ.用下图所示方案,初步定性探究固体的成分。 
(2)无色气体为
(3)加入足量铁屑发生反应的方程式为 、
结论:猜想 不成立。
Ⅲ.固体组成定量测定:
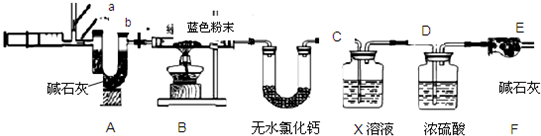
设固体为aCu(OH)2?bCuCO3?cH2O,为测定其组成,称取24.0 g蓝色固体。继续进行实验:
【实验步骤】
图中注射器处为两个单向阀:推注射器时a关闭,b处打开;拉注射器时,a打开进空气,b关闭。
实验步骤 ①组装好装置,检查气密性;②反复推拉注射器;③称量B、C、D、E、F的质量;④关闭弹簧夹,加热B处试管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量B、C、D、E、F的质量。
问题探究:
(4)写出Cu(OH)2、CuCO3分解的化学方程式 、 。
样品分解的总反应方程式 。
说明装置B中样品没有完全反应的现象是
(5)D中的药品为 ,作用是 。
(6)进行步骤⑤的操作,是为了 ,该操作中推注射器时缓缓的目的是 。
数据处理:
| | B | C | D | E | F |
| 反应前 | 124.0g | 250.0g | 300.0g | 350.0g | 360.0g |
| 反应后 | 116.0g | 253.6g | 304.2g | 350.2g | 360.0g |
(8)求该固体的化学式中 a:b:c= 。(写出计算过程,4分)
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某研究性学习小组对固体沉淀的成分进行了如下探究。请完成下列各题:
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示)。
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈 (填“酸”或“碱”)性。
猜想三:固体为Cu(OH)2和CuCO3的混合物。
(二)资料查阅:
①结晶水合物受热后易失去结晶水,如CuSO4•5H2O CuSO4
+ 5H2O↑;
CuSO4
+ 5H2O↑;
②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物。
③无水氯化钙可做吸水剂;碱石灰的主要成分为氢氧化钠固体和氧化钙
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经 、洗涤、室温晾干得蓝色固体。
Ⅱ.用下图所示方案,初步定性探究固体的成分。

(2)无色气体为
(3)加入足量铁屑发生反应的方程式为 、
结论:猜想 不成立。
Ⅲ.固体组成定量测定:
设固体为aCu(OH)2•bCuCO3•cH2O,为测定其组成,称取24.0 g蓝色固体。继续进行实验:
【实验步骤】

图中注射器处为两个单向阀:推注射器时a关闭,b处打开;拉注射器时,a打开进空气,b关闭。
实验步骤 ①组装好装置,检查气密性;②反复推拉注射器;③称量B、C、D、E、F的质量;④关闭弹簧夹,加热B处试管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量B、C、D、E、F的质量。
问题探究:
(4)写出Cu(OH)2、CuCO3分解的化学方程式 、 。
样品分解的总反应方程式 。
说明装置B中样品没有完全反应的现象是
(5)D中的药品为 ,作用是 。
(6)进行步骤⑤的操作,是为了 ,该操作中推注射器时缓缓的目的是 。
数据处理:
|
|
B |
C |
D |
E |
F |
|
反应前 |
124.0g |
250.0g |
300.0g |
350.0g |
360.0g |
|
反应后 |
116.0g |
253.6g |
304.2g |
350.2g |
360.0g |
(7)据下表数据,E装置质量增加的原因是 ;24.0g固体分解出水的质量为 g,;
(8)求该固体的化学式中 a:b:c= 。(写出计算过程,4分)