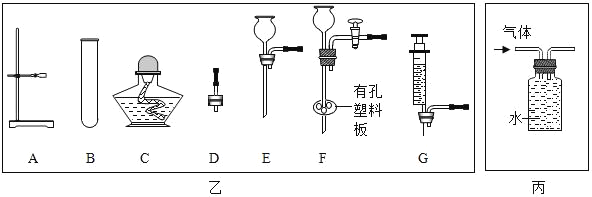
��Ŀ����
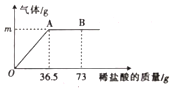
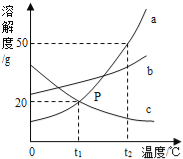
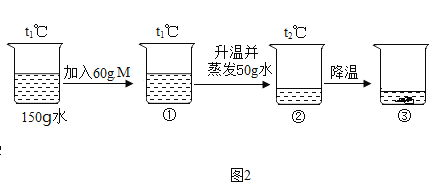
����Ŀ��M��N�ֱ�������غ��Ȼ���е�һ�֣�����غ��Ȼ�淋��ܽ��������ͼ1��ʾ��ij��ѧ��ȤС��������M��������ͼ2��ʾʵ�顣��ش��������⣺
��1��A�����______��
��2������N�Ļ�ѧʽ______��
��3��t2��ʱ�����Ƶ�����������غ��Ȼ�淋ı�����Һ������Ҫ���ܼ������������______�Ȼ�泥�������������С������������������
��4������˵����ȷ����______������ţ�
A ����ص��ܽ�ȴ����Ȼ��
B t2��ʱ������صı�����ҺŨ��һ�����Ȼ����Һ��
C t1��ʱ���Ȼ�淋ı�����Һ�У����ʺ���Һ��������Ϊ4��10
D ͼ2�Ģ٢ڢ��У��ڵ����������������
���𰸡�t2��ʱ������ص��ܽ��Ϊ60g NH4C1 С�� BD
��������
��1�����ܽ�����߿�֪��A�ĺ����ǣ�t2��ʱ������ص��ܽ��Ϊ60g��
��2����ͼ2��֪����t2��ʱ��M����100g�������ܽ�60g������N���ܽ��С��60g����������M������أ�N�������Ȼ�泥���ѧʽ�ǣ�NH4C1��
��3����Һ������=�ܼ�������+���ʵ����������ܽ�����߿�֪��t2��ʱ������ص��ܽ�ȴ����Ȼ�泥����Ƶ�����������غ��Ȼ�淋ı�����Һ������Ҫ���ܼ������������С���Ȼ�李�
��4��A���Ƚ��ܽ�ȱ�����ͬһ�¶��£���ѡ�����
B��t2��ʱ����������ص��ܽ�ȴ����Ȼ�泥���������صı�����ҺŨ��һ�����Ȼ����Һ��ѡ����ȷ��
C��t1��ʱ���Ȼ�淋ı�����Һ�У����ʺ���Һ��������Ϊ40g����100g+40g��=2��7����ѡ�����
D��t1��ʱ������ص��ܽ��Ϊ40g��t2��ʱ������ص��ܽ��Ϊ60g����Һ���У�60g�������ȫ�ܽ⣬��������Ϊ![]() ��100%��28.6%����Һ���У��ܼ������Ѿ�����50g,�¶ȱ�Ϊt2�棬�ʢڵ�������������Ϊ
��100%��28.6%����Һ���У��ܼ������Ѿ�����50g,�¶ȱ�Ϊt2�棬�ʢڵ�������������Ϊ![]() ��100%=37.5%�����Ǣڽ��µõ��ģ�����ص��ܽ�����¶ȵĽ��Ͷ���С��������������Ҫ�Ȣ�С����һ���Ȣٴ�ѡ����ȷ����ѡBD��
��100%=37.5%�����Ǣڽ��µõ��ģ�����ص��ܽ�����¶ȵĽ��Ͷ���С��������������Ҫ�Ȣ�С����һ���Ȣٴ�ѡ����ȷ����ѡBD��

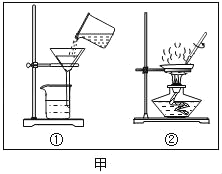
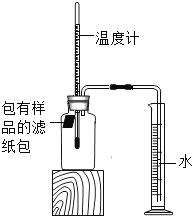
����Ŀ��С����������ʴ��������̽��������ʱ����������Ʒ����ֽ���ô�ͷ��̶��������ϣ�Ѹ��������װ����ͼ���۲쵽��Ͳ��ˮ�ص�������������ƿ�����ݻ�Ϊ146mL�������¶Ȼָ������£�����Ͳ��ˮ��߶Ȳ���ʱ��������ʱƿ��������������Ϊ�㣩����¼��ʼ��������Ͳ�Ķ����Լ�����ʱ�������
��� | ��Ʒ | ��Ͳ��ʼ ����/mL | ��Ͳ���� ����/mL | ����ʱ�� /min |
1 | 1g���ۡ�0.2g̼��10��ˮ | 100 | 70 | Լ120 |
2 | lg���ۡ�0.2g̼��10��ˮ������NaCl | 100 | 70 | Լ70 |
3 | ���� | 100 | 70 | Լ480 |
��1��ʵ��������˵��NaCl����_____����ʴ�����ʡ�
��2��ʵ�鿪ʼ���ƿ���¶�����������˵��������ʴ������_____������ȡ������ȡ������̡�
��3��ʵ�������ȡ����ֽ�����۲쵽�к���ɫ�������ɣ������ʵĻ�ѧʽ��_____��
��4����֪��̼�ܹ��ӿ����������ٶȣ�С����ͨ��ʵ����������̽��̼������ʴ���ʵ�Ӱ�죬���ڱ���հ״���дʵ��������Ʒ���_____��
��5����װ�û������ڲ��������������ĺ����������������ݼ������������������_____��С�������1λ����