题目内容
【题目】下列实验方案不能达到相应实验目的的是
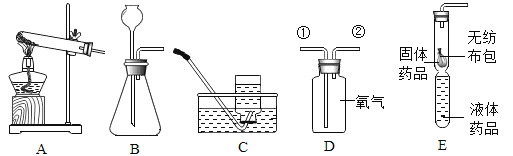
A. 测定空气中氧气含量
测定空气中氧气含量
B.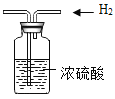 除去氢气中所含水蒸气
除去氢气中所含水蒸气
C.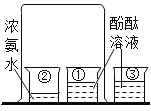 证明分子是不断运动的
证明分子是不断运动的
D. 验证NaOH和CO2发生化学反应
验证NaOH和CO2发生化学反应
【答案】B
【解析】
A、红磷燃烧消耗氧气,最终进入集气瓶中水的体积即为集气瓶中空气中的氧气体积。A正确;
B、干燥氢气,气体应该是长进短出,即氢气从左边导管导入。B错误;
C、①中溶液变红色,是因为氨分子是不断运动的。②烧杯中的氨分子运动到①中时,和水结合生成氨水,从而使酚酞溶液变红色,③中溶液不变色,说明空气中的物质不能使酚酞溶液变色。C正确;
D、滴加氢氧化钠溶液,氢氧化钠和二氧化碳反应,装置中压强变小,气球膨胀,滴加盐酸时,生成的碳酸钠和稀盐酸反应生成二氧化碳,装置中的压强变大,气球缩小,D正确。
故选B。

【题目】下表是元素周期表的部分信息,请根据下表回答有关问题:
3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)1869年,发现了元素周期律并编制元素周期表的科学家是_____(填字母序号);
A 张青莲 B 门捷列夫 C 拉瓦锡 D 汤姆生
(2)表中与锂元素化学性质相似的元素是_____;
(3)由第8号元素和第13号元素的原子形成化合物的化学式为_____;
(4)某离子带2个单位正电荷,其结构示意图如图所示: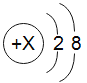 ,该离子的符号是_____;
,该离子的符号是_____;
(5)表中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其原子结构规律可知,每一周期元素原子的_____ 相同。
【题目】为测定4.24g某变质氢氧化钠固体中碳酸钠的质量分数,将其配置成100mL溶液,分成两等分,用如下两种方法进行测定。
加入的试剂 | 测得数据 | |
方法1 | 足量 | 碳酸钡沉淀1.97g |
方法2 | 足量 | 二氧化碳气体0.44g |
请完成上述表格,并自主选择一种方法,计算出样品中碳酸钠的质量分数。