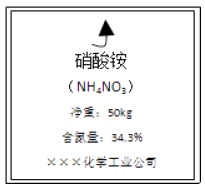
题目内容
【题目】下列说法不正确的是
A.原子的质量主要集中在原子核上
B.分子、原子、离子都是构成物质的微粒
C.原子通过得失电子可以形成离子,但离子不能形成原子
D.氧原子的原子核内有8个质子和8个中子,则氧原子核外一定有8个电子
【答案】C
【解析】
A、原子的质量主要集中在原子核上,A选项说法正确,不符合题意;
B、分子、原子、离子都是构成物质的微粒,B选项说法正确,不符合题意;
C、原子通过得失电子可以形成离子,离子也能形成原子,C选项说法不正确,符合题意;
D、氧原子的原子核内有8个质子和8个中子,原子中核外电子数等于质子数,则氧原子核外一定有8个电子,D选项说法正确,不符合题意。故选C。

【题目】下表为元素周期表中某一周期元素的原子结构示意图。
元素名称 | 钠 | 镁 | 铝 | 硅 |
元素符号 | Na | Mg | Al | Si |
原子结构 示意图 |
|
|
|
|
元素符号 | P | S | Cl | Ar |
原子结构 示意图 |
|
|
|
|
请回答下列问题:
(1)表中磷原子的核电荷数x=______。
(2)表中具有相对稳定结构的元素是________(填名称)。
(3)在化学反应中,每个铝原子失去______个电子形成铝离子。
(4)镁元素与氯元素形成的化合物化学式为________。
(5)上述元素在周期表中处于同一周期的原因是____________________________。
【题目】化学小组同学在课外读物中看到:“通常CO2可作灭火剂,但有些物质(如Na)着火,不能用CO2熄灭。”他们决定探究CO2与Na反应的产物。
【提出猜想】CO2与Na反应可能生成4种物质:C、CO、Na2O、Na2CO3。
【查阅资料】
①Na是非常活泼的金属,常温下与O2、H2O等物质反应。
②碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应。
③Na2O是白色固体,与H2O反应生成NaOH。
④向氯化钯(PdCl2)溶液中通入CO,产生黑色沉淀。
【实验过程】同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)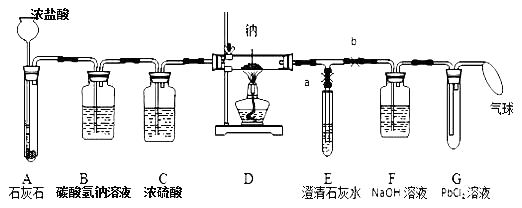
(1)实验记录
序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
① | 打开a,关闭b,由长颈漏斗注入浓盐酸 | A中产生大量气泡E中出现浑浊 | E中反应的化学方程式为 |
② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体G中产生黑色沉淀 | 反应产物一定有和 |
③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有 |
(2)实验反思
①实验记录②中,E中出现浑浊,再点燃酒精灯的目的。
②装置B中发生的反应的化学方程式是 , 若无装置C,对实验有影响的物质是。
③检验第4种反应产物是否存在的实验方案:取D中白色固体于试管中,加水溶解,。
(3)数据分析:若在实验过程中至少需要8.8g二氧化碳参加反应,则最少需要含杂质20%的石灰石的质量是多少?(写出计算过程)