题目内容
【题目】往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
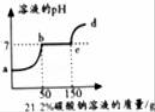
(1)a→b段表示碳酸钠与混合溶液中的 反应;
(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)
【答案】
(1)稀盐酸
(2)15.6%
【解析】试题分析:(1)盐酸和氯化钙的混合溶液中,滴加碳酸钠,盐酸会先与碳酸钠,溶液的pH值升高,然后碳酸钠再与氯化钙反应,溶液的pH值不变,反应结束,继续滴加碳酸钠溶液,溶液的pH值会继续的增大,所以a→b段表示碳酸钠与混合溶液中的稀盐酸反应;
(2)设盐酸和碳酸钠反应时,生成氯化钠质量为x,生成二氧化碳质量为y
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 117 44
21.2%×50g x y
![]() =
=![]() =
=![]()
x=11.7g y=4.4g
碳酸钠和氯化钙反应生成氯化钠质量为m,生成碳酸钙沉淀质量为n
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100 117
21.2%×100g n m
![]() =
=![]() =
=![]()
m=23.4g n=20g
所以所得溶液的溶质质量分数是![]() ×100%=15.6%。
×100%=15.6%。

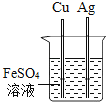
【题目】某同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖.对于该溶液是否变质,同学们开始实验探究并设计如下实验.请你将实验设计补充完整.
【猜想假设】
猜想(1):该溶液没有变质,为NaOH溶液.
猜想(2):该溶液全部变质,为 溶液.
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液.
【查阅资料】Na2CO3溶液呈碱性,氯化钙溶液呈中性.
【设计方案】请你完善下表几组同学探讨的设计方案
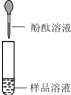
实验操作 | 可能出现的现象与结论 | 同学评价 | |
第1组 |
| 若溶液变红,则猜想(2)不成立 | 第2组同学认为:此方案结论不正确,理由是: . |
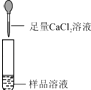
第2组 |
| 若产生白色沉淀,反应方程式是: 则猜想(1)不成立. | 第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立. |
第3组 |
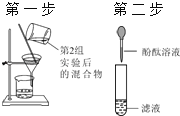
| 若滤液不变红,则猜想(2)成立;若滤液变红,则猜想(3)成立. | 第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是:
|
【探究实验】综合各小组的方案后,动手实验.
【结论与反思】NaOH溶液易与空气中CO2反应而变质,所以要密封保存.
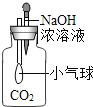
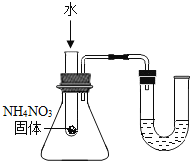
【拓展延伸】同学们设计了下列两套装置进行实验:
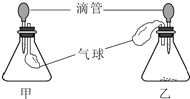
用胶头滴管吸取某种液体,锥形瓶中充入一种气体或放入一种固体物质,挤压胶头滴管.一段时间后,两装置中气球明显胀大.
(1)甲装置中可能发生反应的方程式是 .
(2)若乙装置中胶头滴管吸取的是稀盐酸,则锥形瓶中放入的固体可能是 .