题目内容
某化学兴趣小组利用课余时间在实验室进行如下两个探究实验:
探究一:利用废水回收铜,制备硫酸亚铁晶体.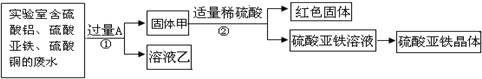
(1)红色固体是
(2)写出步骤①的化学方程式:
探究二:某硫酸亚铁晶体(FeSO4?xH2O)热分解研究
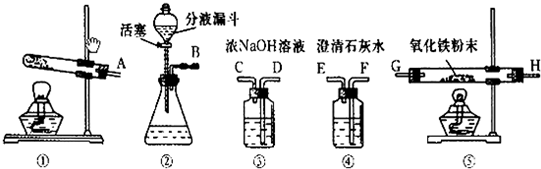
该兴趣小组同学称取ag硫酸亚铁晶体样品按如图所示高温加热,使其完全分解,对所得产物进行探究.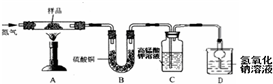
(3)①装置B中硫酸铜粉末变蓝,说明产物中有
③D装置中球形干燥管的作用是
探究一:利用废水回收铜,制备硫酸亚铁晶体.

(1)红色固体是
Cu
Cu
;溶液乙中溶质是硫酸铝和硫酸亚铁或Al2(SO4)3、FeSO4
硫酸铝和硫酸亚铁或Al2(SO4)3、FeSO4
.(2)写出步骤①的化学方程式:
Fe+CuSO4═Cu+FeSO4
Fe+CuSO4═Cu+FeSO4
;探究二:某硫酸亚铁晶体(FeSO4?xH2O)热分解研究
该兴趣小组同学称取ag硫酸亚铁晶体样品按如图所示高温加热,使其完全分解,对所得产物进行探究.

(3)①装置B中硫酸铜粉末变蓝,说明产物中有
水或H2O
水或H2O
,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫或SO2
二氧化硫或SO2
.②硫酸亚铁晶体完全分解后装置A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液,则装置A中红棕色固体是氧化铁或Fe2O3
氧化铁或Fe2O3
.③D装置中球形干燥管的作用是
防止液体倒吸
防止液体倒吸
,氢氧化钠溶液的作用是吸收SO2气体,防止污染空气
吸收SO2气体,防止污染空气
.分析:探究一:为回收废水中的铜,可以使用活动性比铜活泼的金属比如铁将其置换出来;然后依据反应流程图分析所加入的金属和生成物,写出反应方程式;
探究二:①无水硫酸铜白色粉末遇水变蓝,故常用来检验水的存在,二氧化硫能使高锰酸钾溶液褪色;
②根据反应前后元素的种类不变及红棕色固体可与稀盐酸反应生成黄色溶液分析解答;
③硫酸亚铁分解生成的二氧化硫能造成空气污染,可以使用氢氧化钠溶液将其除去.
探究二:①无水硫酸铜白色粉末遇水变蓝,故常用来检验水的存在,二氧化硫能使高锰酸钾溶液褪色;
②根据反应前后元素的种类不变及红棕色固体可与稀盐酸反应生成黄色溶液分析解答;
③硫酸亚铁分解生成的二氧化硫能造成空气污染,可以使用氢氧化钠溶液将其除去.
解答:解:探究一:
(1)废水中含有的硫酸铜加入过量A后得到的固体甲中含有铜和该金属,铜在氢后,与稀硫酸不反应,固体甲中的过量金属与稀硫酸反应生成硫酸亚铁,说明加入的金属是铁.
铁与硫酸铜反应生成硫酸亚铁和铜,铁在铝的后面,不能与硫酸铝反应,所以溶液乙中的溶质是硫酸铝和硫酸亚铁;由于铁过量,所以固体甲中含有铁和铜,加入硫酸与铁反应而铜不反应,所以红色固体为铜;
故答案为:Cu;硫酸铝和硫酸亚铁或Al2(SO4)3、FeSO4;
(2)向废水中加入铁可以与硫酸铜反应生成硫酸亚铁和铜;
故答案为:Fe+CuSO4═Cu+FeSO4;
(3)探究二:
①无水硫酸铜白色粉末遇水变蓝,二氧化硫能使高锰酸钾溶液褪色,所以根据题意可知,硫酸亚铁晶体分解生成水和二氧化硫;
故答案为:水或H2O;二氧化硫或SO2;
②硫酸亚铁晶体分解生成水和二氧化硫及红棕色固体,且红棕色固体放入足量稀盐酸,固体全部溶解,得到黄色溶液,说明该固体为氧化铁;
故答案为:氧化铁或Fe2O3;
③把球形干燥管插入氢氧化钠溶液中的作用是防止液体倒吸,反应生成的二氧化硫是空气污染气体,可以使用氢氧化钠溶液将其吸收;
故答案为:防止液体倒吸;吸收SO2气体,防止污染空气.
(1)废水中含有的硫酸铜加入过量A后得到的固体甲中含有铜和该金属,铜在氢后,与稀硫酸不反应,固体甲中的过量金属与稀硫酸反应生成硫酸亚铁,说明加入的金属是铁.
铁与硫酸铜反应生成硫酸亚铁和铜,铁在铝的后面,不能与硫酸铝反应,所以溶液乙中的溶质是硫酸铝和硫酸亚铁;由于铁过量,所以固体甲中含有铁和铜,加入硫酸与铁反应而铜不反应,所以红色固体为铜;
故答案为:Cu;硫酸铝和硫酸亚铁或Al2(SO4)3、FeSO4;
(2)向废水中加入铁可以与硫酸铜反应生成硫酸亚铁和铜;
故答案为:Fe+CuSO4═Cu+FeSO4;
(3)探究二:
①无水硫酸铜白色粉末遇水变蓝,二氧化硫能使高锰酸钾溶液褪色,所以根据题意可知,硫酸亚铁晶体分解生成水和二氧化硫;
故答案为:水或H2O;二氧化硫或SO2;
②硫酸亚铁晶体分解生成水和二氧化硫及红棕色固体,且红棕色固体放入足量稀盐酸,固体全部溶解,得到黄色溶液,说明该固体为氧化铁;
故答案为:氧化铁或Fe2O3;
③把球形干燥管插入氢氧化钠溶液中的作用是防止液体倒吸,反应生成的二氧化硫是空气污染气体,可以使用氢氧化钠溶液将其吸收;
故答案为:防止液体倒吸;吸收SO2气体,防止污染空气.
点评:本题是一道实验探究题,能较好的考查学生分析和解决问题的能力,考查了常见金属的性质以及某些盐的性质,解答时要依据题干提供信息,结合相关知识细心分析解答.

练习册系列答案
相关题目
不少同学都被蚊虫叮咬过,感觉又痛又痒。从化学课上得知:蚊虫叮咬时能在皮肤内分泌出蚁酸刺激皮肤。查阅资料:蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH,通常是一种无色易挥发的液体,它在浓硫酸存在时加热发生如下反应:HCOOH浓硫酸CO↑+H2O。某化学兴趣小组同学决定使用下图仪器或装置利用甲酸制取CO,并进行CO还原Fe2O3(Fe2O3样品中杂质不参加反应)的探究实验。
请回答下列问题: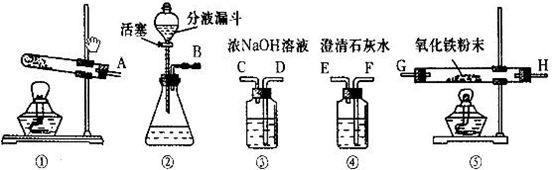
(1)用甲酸滴入浓硫酸的方法制取CO,应选用的发生装置是 (填代号,下同);要除去CO中含有的少量甲酸蒸汽,最好选用上图中的 进行洗气;检验CO还原Fe2O3的气体产物应选用 装置,需检验的气体应从 管口进入。
(2)写出CO还原Fe2O3的化学方程式______________________________。
(3)从开始加热到实验结束,Fe2O3粉末的颜色是如何变化的?_________________。
(4)CO有毒,从环保角度看,如何处理该实验的尾气?_________________。
(5)【拓展延伸】①当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒。下列物质中,你不会选择的物质是________。
| A.氨水 | B.食醋 | C.肥皂水 | D.苏打水 |
(6)利用以上装置可以测定Fe2O3样品中Fe2O3的质量分数。测定方法是:取10.0g Fe2O3样品做实验,先称量样品和玻璃管的总质量为60.0g,待样品完全反应并冷却后,在称量玻璃管和剩余固体的总质量为57.6g。求该样品中Fe2O3的质量分数是多少?