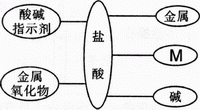
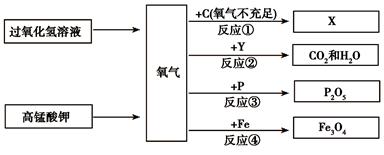
题目内容
地球是一颗蓝色的星球,表面大部分被海洋覆盖,海水中蕴含的元素多达80多种。通过海水晒制可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。以下是一种制备精盐的实验方案,步骤如下:
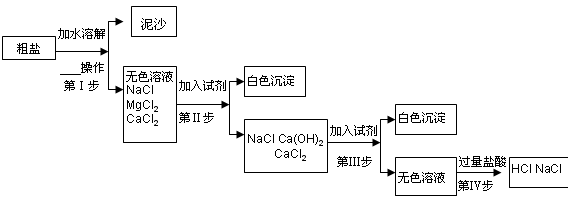
回答下列问题:
(1)小星对粗盐进行初步提纯第Ⅰ步进行 操作。
(2)小明在第Ⅱ步中,欲将MgCl2去除,选择添加NaOH溶液,请写出该反应的化学方程式 。但小亮同学对小明设想提出不同意见,他认为应该用Ca(OH)2代替NaOH,理由是 。
(3)小琴对第Ⅲ步进行实验,要将溶液中的Ca2+沉淀出来,必然加一种常见的盐,该盐为 ,反应化学方程式为 ,该盐要加过量的目的是 ,据此分析,经过第Ⅲ步除去不溶物后,所得溶液的所有溶质有 。
(4)第Ⅳ步中,小琴加入过量盐酸,除去溶液中所有杂质后,认为过量的盐酸也并不是新引入的杂质,经过加热蒸发,盐酸也可以除去,小琴利用了盐酸的
性。

回答下列问题:
(1)小星对粗盐进行初步提纯第Ⅰ步进行 操作。
(2)小明在第Ⅱ步中,欲将MgCl2去除,选择添加NaOH溶液,请写出该反应的化学方程式 。但小亮同学对小明设想提出不同意见,他认为应该用Ca(OH)2代替NaOH,理由是 。
(3)小琴对第Ⅲ步进行实验,要将溶液中的Ca2+沉淀出来,必然加一种常见的盐,该盐为 ,反应化学方程式为 ,该盐要加过量的目的是 ,据此分析,经过第Ⅲ步除去不溶物后,所得溶液的所有溶质有 。
(4)第Ⅳ步中,小琴加入过量盐酸,除去溶液中所有杂质后,认为过量的盐酸也并不是新引入的杂质,经过加热蒸发,盐酸也可以除去,小琴利用了盐酸的
性。
(1)过滤
(2)2NaOH + MgCl2 =Mg(OH)2 ↓ + 2NaCl NaOH价格较贵,使成本过高
(3)Na2CO3 Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
或者:Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH 确保Ca2+完全沉降。
NaCl 、Na2CO3、NaOH
(4) 挥发性。
(2)2NaOH + MgCl2 =Mg(OH)2 ↓ + 2NaCl NaOH价格较贵,使成本过高
(3)Na2CO3 Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
或者:Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH 确保Ca2+完全沉降。
NaCl 、Na2CO3、NaOH
(4) 挥发性。
(1)固液分离的方法为过滤。
(2)MgCl2与NaOH反应方程式为 2NaOH + MgCl2 =Mg(OH)2 ↓ + 2NaCl
因为 NaOH价格较贵,使用成本过高,所以要换成熟石灰。
(3)钙的沉淀有碳酸钙,所以可以加入碳酸钠。Na2CO3 Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
或者:Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH ,加入过量目的是除尽钙离子,反应生成氯化钠、氢氧化钠,所以有二者,碳酸钠过量,所以有碳酸钠。
(4)盐酸有挥发性,加热后就挥发了。
(2)MgCl2与NaOH反应方程式为 2NaOH + MgCl2 =Mg(OH)2 ↓ + 2NaCl
因为 NaOH价格较贵,使用成本过高,所以要换成熟石灰。
(3)钙的沉淀有碳酸钙,所以可以加入碳酸钠。Na2CO3 Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
或者:Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH ,加入过量目的是除尽钙离子,反应生成氯化钠、氢氧化钠,所以有二者,碳酸钠过量,所以有碳酸钠。
(4)盐酸有挥发性,加热后就挥发了。

练习册系列答案
相关题目