题目内容
为了配制100mL 1mol/L的NaOH溶液,其中有下列几个操作:
①NaOH固体放在纸上进行称量
②选刚用蒸馏水洗净的100mL容量瓶进行配制
③NaOH在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中
④用蒸馏水洗涤烧杯内壁2次,洗涤液也均转入容量瓶中
⑤使蒸馏水沿玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切.
其中错误的是
- A.①②③
- B.③④⑤
- C.②③⑤
- D.①③⑤
D
分析:①NaOH固体具有吸水性,易潮解,应放在烧杯进行称量;
②选刚用蒸馏水洗净的100mL容量瓶进行配制;
③NaOH溶于水放热,所以不能立即把溶液转移到容量瓶中;
④根据烧杯沾有溶质;
⑤为了防止加水超过刻度线,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加.
解答:①NaOH固体具有吸水性,易潮解,应放在烧杯进行称量,故错误;
②选刚用蒸馏水洗净的100mL容量瓶进行配制,故正确;
③NaOH溶于水放热,所以不能立即把溶液转移到容量瓶中,故错误;
④用蒸馏水洗涤烧杯内壁2次,洗涤液也均转入容量瓶中,故正确;
⑤为了防止加水超过刻度线,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,故错误.
故选:D.
点评:本题主要考查了配制一定物质的量的溶液的配制方法和注意事项,难度不大,根据课本知识即可完成.
分析:①NaOH固体具有吸水性,易潮解,应放在烧杯进行称量;
②选刚用蒸馏水洗净的100mL容量瓶进行配制;
③NaOH溶于水放热,所以不能立即把溶液转移到容量瓶中;
④根据烧杯沾有溶质;
⑤为了防止加水超过刻度线,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加.
解答:①NaOH固体具有吸水性,易潮解,应放在烧杯进行称量,故错误;
②选刚用蒸馏水洗净的100mL容量瓶进行配制,故正确;
③NaOH溶于水放热,所以不能立即把溶液转移到容量瓶中,故错误;
④用蒸馏水洗涤烧杯内壁2次,洗涤液也均转入容量瓶中,故正确;
⑤为了防止加水超过刻度线,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,故错误.
故选:D.
点评:本题主要考查了配制一定物质的量的溶液的配制方法和注意事项,难度不大,根据课本知识即可完成.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
(1)查得室温下10%氢氧化钠溶液的密度为1.02g/cm3,配制100mL这种氢氧化钠溶液,需氢氧化钠 g,其配制过程是 .
如用 mL(填“10mL”、“50mL”或“100mL”)量筒量取水时,面对刻度线,仰视读数,则所配制的溶液 10%(填“=”、“>”或“<”)
(2)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线.
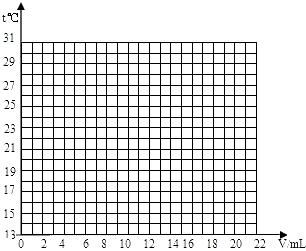
(3)根据曲线讨论溶液温度变化的原因.
①加入盐酸的量在2mL~10mL之间时: .
②加入盐酸的量在10mL~20mL之间时: .
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答: .
(5)在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
①你认为此结论是否正确? ,理由是 ;
②写出该中和反应的化学方程式 ;
③请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(t)/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
如用
(2)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线.

(3)根据曲线讨论溶液温度变化的原因.
①加入盐酸的量在2mL~10mL之间时:
②加入盐酸的量在10mL~20mL之间时:
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:
(5)在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
①你认为此结论是否正确?
②写出该中和反应的化学方程式
③请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 实验方法 | 可能观察到的现象 | 结论 |