题目内容
(14分)①现有Fe、H2O2、AgNO3溶液、MgCl2溶液、水、稀盐酸、氧气、Fe2O3,从以上几种物质中选出反应物,按下列要求写出化学方程式。
(1)化合反应 ;(2)置换反应 ;
(3)酸与盐反应 ;(4)盐与盐反应 ;
(5)酸与氧化物反应 ;(6)分解反应 ;
②治疗胃酸过多药物的主要成分是Al(OH)3,其治疗原理是 。
(1)化合反应 ;(2)置换反应 ;
(3)酸与盐反应 ;(4)盐与盐反应 ;
(5)酸与氧化物反应 ;(6)分解反应 ;
②治疗胃酸过多药物的主要成分是Al(OH)3,其治疗原理是 。
①(1)3Fe+2O2 Fe3O4;(2) Fe+2AgNO3
Fe3O4;(2) Fe+2AgNO3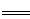 Fe(NO3)2+2Ag;
Fe(NO3)2+2Ag;
(3)HCl+AgNO3 HNO3+AgCl↓;(4)2AgNO3+MgCl2 ==Mg(NO3)2+2AgCl↓;
HNO3+AgCl↓;(4)2AgNO3+MgCl2 ==Mg(NO3)2+2AgCl↓;
(5)6HCl+Fe2O3 2FeCl3+3H2O;(6)2H2O2
2FeCl3+3H2O;(6)2H2O2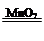 2H2O+O2↑;
2H2O+O2↑;
②3HCl+Al(OH)3 AlCl3+3H2O
AlCl3+3H2O
 Fe3O4;(2) Fe+2AgNO3
Fe3O4;(2) Fe+2AgNO3 Fe(NO3)2+2Ag;
Fe(NO3)2+2Ag; (3)HCl+AgNO3
 HNO3+AgCl↓;(4)2AgNO3+MgCl2 ==Mg(NO3)2+2AgCl↓;
HNO3+AgCl↓;(4)2AgNO3+MgCl2 ==Mg(NO3)2+2AgCl↓;(5)6HCl+Fe2O3
 2FeCl3+3H2O;(6)2H2O2
2FeCl3+3H2O;(6)2H2O2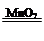 2H2O+O2↑;
2H2O+O2↑;②3HCl+Al(OH)3
 AlCl3+3H2O
AlCl3+3H2O试题分析:①(1)铁在氧气中燃烧生成四氧化三铁,化学方程式为Fe+2O2
 Fe3O4,符合化合反应的特点“多变一”;
Fe3O4,符合化合反应的特点“多变一”;(2)置换反应是一种单质和一种化合物反应生成另一种单质和另一种化合物,Fe与AgNO3反应生成Fe(NO3)2、2Ag符合置换反应的特点,其化学方程式为Fe+2AgNO3
 Fe(NO3)2+2Ag;
Fe(NO3)2+2Ag;(3)稀盐酸是酸,AgNO3是盐,二者反应的化学方程式为HCl+AgNO3
 HNO3+AgCl↓;
HNO3+AgCl↓;(4)AgNO3、MgCl2属于盐,二者反应的方程式为2AgNO3+MgCl2 ==Mg(NO3)2+2AgCl↓;
(5)稀盐酸是酸,Fe2O3是氧化物,二者反应的方程式为6HCl+Fe2O3
 2FeCl3+3H2O;
2FeCl3+3H2O;(6)过氧化氢在二氧化锰的催化作用下生成水和氧气,符合分解反应的特点“一变多”,其化学方程式为2H2O2
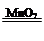 2H2O+O2↑;
2H2O+O2↑;②胃酸的主要成分为盐酸,Al(OH)3为碱,酸碱中和反应,可降低过多的胃酸,其反应方程式为3HCl+Al(OH)3
 AlCl3+3H2O。
AlCl3+3H2O。点评:解此类题的关键是找对反应物、生成物,然后方程式的书写规则写出方程式。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目