题目内容
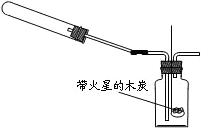
同学们学习了《金属与矿物》一章后,对金属的有关性质产生了浓厚的兴趣.探究一:某小组做了如下图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:

[研究课题]探究红色粉末的主要成分
[查阅资料]
(1)有关物质的颜色:CuO粉末:黑色,Cu2O粉末:红色
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:
CuO十H2SO4=CuSO4+H2O
Cu2O+H2SO4=CuSO4+Cu+H2O
[猜想与实验]
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测.
| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |
A.反应前CuO粉末的质量;B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量;D.反应后固体混合物的总质量
探究二:实验室通常利用反应“Zn+H2SO4=ZnSO4+H2↑”可以制氢气.
(1)探究小组发现实验室制氢气常用粗锌(含杂质的锌)而不用纯锌,原因是粗锌跟硫酸反应放出氢气的速率比纯锌快.现将等质量的两份纯锌粉分别加入a,b两个烧杯中,两烧杯中均各盛有相同的过量稀硫酸,同时向a烧杯中加入少量的CuO粉末,充分反应后两烧杯中:
①产生氢气的质量:a______b(填“<,>,或=”)
②产生氢气的速率:a______b(填“<,>,或=”)
(2)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示.试计算:
①样品中铜的质量分数为:______.
②恰好完全反应时所消耗稀硫酸的质量为______克.

【答案】分析:探究一:[猜想与实验](1)如果红色粉末只是一种物质时,可能是Cu或Cu2O,因为Cu不与酸反应而Cu2O能和酸反应,所以滴入稀硫酸即可鉴别;
(2)根据反应前CuO粉末的质量算出铜元素的质量,再用反应后固体混合物的总质量减去铜元素的质量,就是Cu2O中氧元素的质量,进而求出Cu2O的质量再求它们的质量分数.
探究二:(1)等质量的两份纯锌粉与过量稀硫酸反应时,生成氢气的质量按锌算,又因为锌质量相等所以产生氢气的质量也相等;
粗锌跟硫酸反应放出氢气的速率比纯锌快,所以加入少量的CuO粉末的要比什么都没加的快.
(2)由图可知生成氢气的质量为0.1g,根据氢气质量算出锌质量和硫酸质量,用10g减去锌的质量就是铜的质量,再算铜的质量分数;用硫酸的质量除以9.8%就是硫酸溶液的质量.
解答:解:探究一:[猜想与实验](1)将红色粉末放入试管中,再向试管中滴加稀硫酸,如果不反应,红色物质就是铜,如果反应且溶液变为蓝色说明红色物质是Cu2O;
(2)用反应前CuO粉末的质量乘以铜元素在氧化铜中的质量分数,算出铜元素质量,再用反应后固体混合物的总质量减去铜元素的质量,就是Cu2O中氧元素的质量,用氧元素的质量除以Cu2O中氧元素的质量分数,算出Cu2O的质量再求出它们的质量分数.
探究二:(1)因为是等质量的两份纯锌粉与过量稀硫酸反应,生成氢气的质量按锌算,又因为锌质量相等所以产生氢气的质量也相等;由于粗锌跟硫酸反应放出氢气的速率比纯锌快,所以加入少量的CuO粉末的要比什么都没加的快.
(2)由图可知生成氢气的质量为0.1g,设要想生成0.1g氢气需要参加反应的锌的质量为x,参加反应的硫酸质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.1g
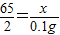 ,解得x=3.25g;
,解得x=3.25g;
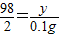 ,解得y=4.9g;
,解得y=4.9g;
铜的质量分数: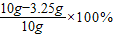 =67.5%,稀硫酸的质量:
=67.5%,稀硫酸的质量: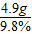 =50g;
=50g;
故答案为:探究一:[猜想与实验](1)将红色粉末放入试管中,再向试管中滴加稀硫酸.(2)AD.
探究二:(1)①═②;>.(2)①67.5%; ②50g.
点评:本题主要考查物质组成的推断,关键理清玻璃管中质量为什么减少?生成物是什么?铜元素的质量没有减少,再推断.
(2)根据反应前CuO粉末的质量算出铜元素的质量,再用反应后固体混合物的总质量减去铜元素的质量,就是Cu2O中氧元素的质量,进而求出Cu2O的质量再求它们的质量分数.
探究二:(1)等质量的两份纯锌粉与过量稀硫酸反应时,生成氢气的质量按锌算,又因为锌质量相等所以产生氢气的质量也相等;
粗锌跟硫酸反应放出氢气的速率比纯锌快,所以加入少量的CuO粉末的要比什么都没加的快.
(2)由图可知生成氢气的质量为0.1g,根据氢气质量算出锌质量和硫酸质量,用10g减去锌的质量就是铜的质量,再算铜的质量分数;用硫酸的质量除以9.8%就是硫酸溶液的质量.
解答:解:探究一:[猜想与实验](1)将红色粉末放入试管中,再向试管中滴加稀硫酸,如果不反应,红色物质就是铜,如果反应且溶液变为蓝色说明红色物质是Cu2O;
(2)用反应前CuO粉末的质量乘以铜元素在氧化铜中的质量分数,算出铜元素质量,再用反应后固体混合物的总质量减去铜元素的质量,就是Cu2O中氧元素的质量,用氧元素的质量除以Cu2O中氧元素的质量分数,算出Cu2O的质量再求出它们的质量分数.
探究二:(1)因为是等质量的两份纯锌粉与过量稀硫酸反应,生成氢气的质量按锌算,又因为锌质量相等所以产生氢气的质量也相等;由于粗锌跟硫酸反应放出氢气的速率比纯锌快,所以加入少量的CuO粉末的要比什么都没加的快.
(2)由图可知生成氢气的质量为0.1g,设要想生成0.1g氢气需要参加反应的锌的质量为x,参加反应的硫酸质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.1g
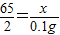 ,解得x=3.25g;
,解得x=3.25g;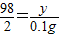 ,解得y=4.9g;
,解得y=4.9g;铜的质量分数:
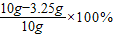 =67.5%,稀硫酸的质量:
=67.5%,稀硫酸的质量: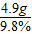 =50g;
=50g;故答案为:探究一:[猜想与实验](1)将红色粉末放入试管中,再向试管中滴加稀硫酸.(2)AD.
探究二:(1)①═②;>.(2)①67.5%; ②50g.
点评:本题主要考查物质组成的推断,关键理清玻璃管中质量为什么减少?生成物是什么?铜元素的质量没有减少,再推断.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
同学们学习了《金属与矿物》一章后,对金属的有关性质产生了浓厚的兴趣.
探究一:某小组做了如下图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:

[研究课题]探究红色粉末的主要成分
[查阅资料]
(1)有关物质的颜色:CuO粉末:黑色,Cu2O粉末:红色
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:
CuO十H2SO4=CuSO4+H2O
Cu2O+H2SO4=CuSO4+Cu+H2O
[猜想与实验]
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测.
(2)如果硬质玻璃管内红色粉末为两种物质的混合物,要确定粉末中两种物质的质量分数,还需要通过有关数据计算进行判断.下列数据为计算依据的是( )
A.反应前CuO粉末的质量;B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量;D.反应后固体混合物的总质量
探究二:实验室通常利用反应“Zn+H2SO4=ZnSO4+H2↑”可以制氢气.
(1)探究小组发现实验室制氢气常用粗锌(含杂质的锌)而不用纯锌,原因是粗锌跟硫酸反应放出氢气的速率比纯锌快.现将等质量的两份纯锌粉分别加入a,b两个烧杯中,两烧杯中均各盛有相同的过量稀硫酸,同时向a烧杯中加入少量的CuO粉末,充分反应后两烧杯中:
①产生氢气的质量:a b(填“<,>,或=”)
②产生氢气的速率:a b(填“<,>,或=”)
(2)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示.试计算:
①样品中铜的质量分数为: .
②恰好完全反应时所消耗稀硫酸的质量为 克.
探究一:某小组做了如下图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:

[研究课题]探究红色粉末的主要成分
[查阅资料]
(1)有关物质的颜色:CuO粉末:黑色,Cu2O粉末:红色
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:
CuO十H2SO4=CuSO4+H2O
Cu2O+H2SO4=CuSO4+Cu+H2O
[猜想与实验]
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测.
| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |
A.反应前CuO粉末的质量;B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量;D.反应后固体混合物的总质量
探究二:实验室通常利用反应“Zn+H2SO4=ZnSO4+H2↑”可以制氢气.
(1)探究小组发现实验室制氢气常用粗锌(含杂质的锌)而不用纯锌,原因是粗锌跟硫酸反应放出氢气的速率比纯锌快.现将等质量的两份纯锌粉分别加入a,b两个烧杯中,两烧杯中均各盛有相同的过量稀硫酸,同时向a烧杯中加入少量的CuO粉末,充分反应后两烧杯中:
①产生氢气的质量:a
②产生氢气的速率:a
(2)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示.试计算:

①样品中铜的质量分数为:
②恰好完全反应时所消耗稀硫酸的质量为
同学们学习了《金属与矿物》一章后,对金属的有关性质产生了浓厚的兴趣.
探究一:某小组做了如下图所示的探究实验.实验发现CO与CuO加热后黑色粉末变成红色粉末.请你参与该小组的研究过程并完成相关任务:
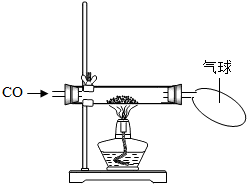
[研究课题]探究红色粉末的主要成分
[查阅资料]
(1)有关物质的颜色:CuO粉末:黑色,Cu2O粉末:红色
(2)CuO和Cu2O都能和稀硫酸发生反应,化学方程式为:
CuO十H2SO4=CuSO4+H2O
Cu2O+H2SO4=CuSO4+Cu+H2O
[猜想与实验]
(1)如果硬质玻璃管内红色粉末为一种物质,请猜想它的成分,并设计简单的实验证明你的猜测.
| 猜想 | 简单实验方案 | 现象 | CO和CuO反应的化学方程式 |
| 粉末为Cu | 不反应 | CuO+CO=Cu+CO2 | |
| 粉末溶解,溶液变成蓝色,生成红色粉末 | 2CuO+CO=Cu2O+CO2 |
A.反应前CuO粉末的质量;B.硬质玻璃管中固体物质减少的质量
C.通入CO的质量;D.反应后固体混合物的总质量
探究二:实验室通常利用反应“Zn+H2SO4=ZnSO4+H2↑”可以制氢气.
(1)探究小组发现实验室制氢气常用粗锌(含杂质的锌)而不用纯锌,原因是粗锌跟硫酸反应放出氢气的速率比纯锌快.现将等质量的两份纯锌粉分别加入a,b两个烧杯中,两烧杯中均各盛有相同的过量稀硫酸,同时向a烧杯中加入少量的CuO粉末,充分反应后两烧杯中:
①产生氢气的质量:a________b(填“<,>,或=”)
②产生氢气的速率:a________b(填“<,>,或=”)
(2)为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如右图所示.试计算:
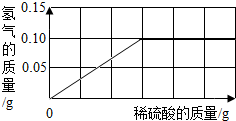
①样品中铜的质量分数为:________.
②恰好完全反应时所消耗稀硫酸的质量为________克.