题目内容
【题目】用化学符号和化学式表示:
两个镁原子__________;硫酸根离子________________ ;
氧化铝中铝元素显正3价_________;磁铁矿的主要成分___________。
【答案】2Mg SO42- ![]() Fe3O4
Fe3O4
【解析】
由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故两个镁原子表示为:2Mg。
由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。硫酸根离子可表示为:SO42-。
由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化铝中铝元素显正3价可表示为:![]() ;
;
磁铁矿的主要成分是四氧化三铁,其化学式为Fe3O4。

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
【题目】下图为实验室制氧气的装置图。请从A或B两题中任选一个作答,若两题均作答,按A计分。
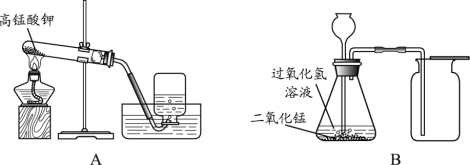
A | B |
(1)A图中反应的化学方程式为________。 (2)O2可用排水法收集,其原因是________。 | (1)B图中反应的化学方程式为________。 (2)B中长颈漏斗底端伸入液体内的原因是________。 |