题目内容
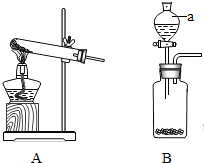 实验室可用高锰酸钾制取氧气(如装置图A),也可用过氧化氢溶液和二氧化锰粉末来制取氧气(如装置图B).装置B中的a是分液漏斗,通过活塞的开关可以随时滴加过氧化氢溶液,从而控制得到氧气的量.
实验室可用高锰酸钾制取氧气(如装置图A),也可用过氧化氢溶液和二氧化锰粉末来制取氧气(如装置图B).装置B中的a是分液漏斗,通过活塞的开关可以随时滴加过氧化氢溶液,从而控制得到氧气的量.(1)请写出其中一个制取氧气的化学方程式
(2)从反应物状态和反应条件来比较装置A和装置B的差异.
| 装置A | 装置B | |
| 应物状态和反应条件 |
(4)加热氯酸钾固体和二氧化锰粉末也可制取氧气,用该方法制取氧气应选用以上哪种气体发生装置?
(5)请描述如何检查A装置的气密性.
(6)确定实验室收集气体装置的依据是什么?
(7)在实验室里称取7g含有杂质的锌放入烧杯中,向其中加入100g一定质量分数的稀盐酸(杂质不参与反应),恰好完全反应.反应后,称量烧杯中剩余物的总质量为106.8g.则参加反应的锌是多少克?稀盐酸中溶质的质量分数是多少?
分析:(1)熟记实验室制取氧气的化学反应式;
(2)观察图示AB,比较反应物状态和反应条件的区别;
(3)根据操作的要点,分析对应的性质;
(4)根据反应的条件和反应物的状态来选择.
(5)根据检查气密性的要点一密闭而制造装置内外压强差三叙述现象来描述.
(6)收集气体一般根据气体的密度、溶解性等.
(7)反应前后质量差为氢气的质量,根据反应的化学方程式进行求解.
(2)观察图示AB,比较反应物状态和反应条件的区别;
(3)根据操作的要点,分析对应的性质;
(4)根据反应的条件和反应物的状态来选择.
(5)根据检查气密性的要点一密闭而制造装置内外压强差三叙述现象来描述.
(6)收集气体一般根据气体的密度、溶解性等.
(7)反应前后质量差为氢气的质量,根据反应的化学方程式进行求解.
解答:解:(1)用过氧化氢溶液和二氧化锰粉末来制取氧气的化学方程式为:2H2O2
2H2O+O2↑
用高锰酸钾制取氧气的化学方程式为:2KMnO4
K2MnO4+MnO2+O2↑(1分)
(2)装置A,反应物的状态是固体,反应条件是加热;装置B,反应物的状态是液体,反应的条件是不需加热.
故答案为:
(3)向上排空气法收集氧气说明密度大于空气,并用带火星的木条点燃,说明氧气有助燃性.故答案为:密度比空气大、助燃性
(4)加热氯酸钾固体和二氧化锰粉末制取氧气,反应物是固体,条件是加热,所以选A装置.故答案为:A
(5)将试管所连的导管放入水中,用手紧握握热试管,若导管口冒气泡,松手后导管内形成稳定的水柱,则可证明气密性良好.
(6)收集气体一般如果气体不和空气反应,若密度大于空气用向上排空气法,否则用向下排空气法;若不合水反应,不溶于水则用排水法.
故答案为:所制得气体的性质,如溶解性和密度等
(7)解:生成氢气的质量为:7g+1OOg-1O6.8g=O.2g
设参加反应的锌的质量为x,稀盐酸小氯化氢的质量为y.
Zn+2HCl=ZnCl2+H2↑
65 73 2
x y O.2g
=
=
解之得:x=6.5g,y=7.3g
稀盐酸中溶质的质量分数=
×100%=7.3%
答:参加反应的锌是6.5克,稀盐酸中溶质的质量分数7.3%
| ||
用高锰酸钾制取氧气的化学方程式为:2KMnO4
| ||
(2)装置A,反应物的状态是固体,反应条件是加热;装置B,反应物的状态是液体,反应的条件是不需加热.
故答案为:
| 装置A | 装置B | |
| 应物状态和反应条件 | 反应物为固体,需加热 | 反应物为液体(或液体和固体),不需加热 |
(4)加热氯酸钾固体和二氧化锰粉末制取氧气,反应物是固体,条件是加热,所以选A装置.故答案为:A
(5)将试管所连的导管放入水中,用手紧握握热试管,若导管口冒气泡,松手后导管内形成稳定的水柱,则可证明气密性良好.
(6)收集气体一般如果气体不和空气反应,若密度大于空气用向上排空气法,否则用向下排空气法;若不合水反应,不溶于水则用排水法.
故答案为:所制得气体的性质,如溶解性和密度等
(7)解:生成氢气的质量为:7g+1OOg-1O6.8g=O.2g
设参加反应的锌的质量为x,稀盐酸小氯化氢的质量为y.
Zn+2HCl=ZnCl2+H2↑
65 73 2
x y O.2g
| 65 |
| x |
| 73 |
| y |
| 2 |
| 0.2g |
解之得:x=6.5g,y=7.3g
稀盐酸中溶质的质量分数=
| 7.3g |
| 100g |
答:参加反应的锌是6.5克,稀盐酸中溶质的质量分数7.3%
点评:本题以制备氧气为载体,考查了学生对反应原理、装置的选择、收集的原理和气密性的检查等知识点,学生一定要认真分析本题做到真正学会.

练习册系列答案
相关题目
 如图是实验室加热高锰酸钾制取和收集氧气的装置图.
如图是实验室加热高锰酸钾制取和收集氧气的装置图.
 如图是实验室加热高锰酸钾制氧气的装置图,试回答下列问题:
如图是实验室加热高锰酸钾制氧气的装置图,试回答下列问题: