题目内容
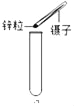
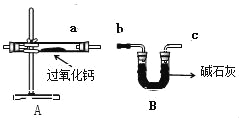
【题目】过氧化钙(CaO2)是一种用途广泛的优良供氧剂,白色固体,微溶于水,可用于鱼类养殖。某兴趣小组探究过氧化钙的部分化学性质,装置如图。
(资料检索)
Ⅰ.过氧化钙与水反应 2CaO2+2H2O=2Ca(OH)2+O2↑
Ⅱ.过氧化钙与足量的稀盐酸反应2CaO2+4HCl=2CaCl2+2H2O+O2↑
(实验探究)
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 1、向玻璃管中加入过氧化钙,将A左侧管口换成无孔塞,加热到315℃,并保持一段时间直至完全反应,用带火星的木条放在a导管口 | 木条复燃 | 有 _____生成 |
2、待玻璃管冷却,取管中少量白色固体,①加适量水充分搅拌;②滴几滴酚酞试液 | ① _____②变红色 | 固体是氧化钙 | |
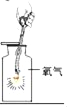
实验二 | 1、换装过氧化钙,将A左侧管口换成单孔塞,连接a,b导管,通入二氧化碳气体充分反应,同时把带火星的木条放在c导管口。 | 木条复燃,固体仍是白色 | |
2、取适量玻璃管中白色固体,_____。 | _____ | 固体是碳酸钙 |
(解释与结论)
(1)由实验一可知,过氧化钙受热会分解,写出步骤2中白色固体与水反应的化学方程式:_____。
(2)由实验二可知,过氧化钙能与二氧化碳发生反应,写出其化学方程式:_____。
(3)B装置中碱石灰的作用是:_____
(分析与计算)
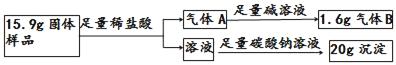
现有一敞口在空气中的过氧化钙固体样品,通过下列实验,探究其中各成分的质量比为_____。
【答案】氧气放热(或水温升高)加入稀盐酸,把气体通入澄清的石灰水中有气泡产生,石灰水变浑浊CaO+H2O=Ca(OH)2 。2CaO2+2CO2=2CaCO3+O2 。吸收未反应的二氧化碳气体(或除去氧气中的二氧化碳)CaO2:Ca(OH)2:CaCO3=72:37:50 。
【解析】
根据氧气的助燃性以及氧化钙与水反应放出热量,碳酸钙的化学性质,实验一、二的化学反应的原理,碱石灰的性质与作用,气体的质量、生成沉淀的质量利用化学方程式进行计算分析解答。
实验探究:
实验一:1、氧气具有助燃性,能使带火星的木条复燃,所以1中生成的气体是氧气;
2、步骤2中白色固体是氧化钙,氧化钙与水反应生成氢氧化钙,此反应过程中会放出大量的热,所以反应现象为放热(或水温升高);
实验二:若该白色固体是碳酸钙,碳酸钙与盐酸反应生成二氧化碳,二氧化碳气体能使澄清的石灰水变浑浊。所以实验步骤是取适量玻璃管中白色固体,加入稀盐酸,把气体通入澄清的石灰水中;实验现象是有气泡产生,石灰水变浑浊;
解释与结论:
(1)实验一步骤2中白色固体是氧化钙,氧化钙与水反应生成氢氧化钙,反应的化学方程式是CaO+H2O=Ca(OH)2;
(2)由实验二可知,过氧化钙与二氧化碳反应生成碳酸钙和氧气,反应的化学方程式是2CaO2+2CO2=2CaCO3+O2;
(3)B装置中碱石灰是由氧化钙和氢氧化钙组成,可以吸收未参加反应的二氧化碳气体,即除去氧气中的二氧化碳;
分析与计算:
该固体加入盐酸后生成了氯化钙和气体,气体能被碱溶液吸收一部分,这是二氧化碳,还余下1.6g气体,是氧气。根据实验探究可知,该固体中存在CaO2、CaCO3 、Ca(OH)2。
设:与盐酸反应生成1.6g氧气需要过氧化钙的质量为x,生成氯化钙的质量为y,则:
2CaO2+4HCl=2CaCl2+2H2O+O2↑
144 222 32
x y 1.6g
![]() x=7.2g
x=7.2g
![]() y=11.1g
y=11.1g
设:设生成20g的碳酸钙需氯化钙的质量为m
Na2CO3+CaCl2=CaCO3↓+2NaCl
111 100
m 20g
![]()
![]() m=22.2g
m=22.2g
样品的总质量为15.9g,所以其中氢氧化钙与碳酸钙的质量为:15.9g﹣7.2g=8.7g;碳酸钙、氢氧化钙与盐酸反应生成氯化钙的质量和为:22.2g﹣11.1g=11.1g;
设:样品中氢氧化钙的质量为a,与盐酸反应生成氯化钙的质量为b,则样品中碳酸钙的质量为:8.7g﹣a,与盐酸反应生成氯化钙的质量为:11.1g﹣b,则
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111
8.7g﹣a 11.1g﹣b
①![]()
Ca(OH)2+2HCl=CaCl2+2H2O
74 111
a b
②![]()
由①②可得:a=3.7g,则样品中碳酸钙的质量为:8.7g﹣3.7g=5g,所以过氧化钙固体样品中过氧化钙、氢氧化钙、碳酸钙的质量比为:7.2g:3.7g:5g=72:37:50。