题目内容
【题目】根据下列实验装置图回答问题:
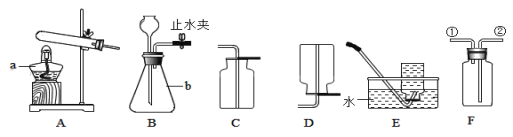
⑴请填写标号仪器的名称:a.______,b._______;
⑵用高锰酸钾为原料制氧气选用的发生装置是_____(填装置代号),还需在该图中添加_____,排水法收集氧气实验结束时应_________然后_________;
⑶如果用排空气法收集,检验氧气是否收集满的方法是___,如用F装置收集氧气,气体应从___进入(填接口序号)。
⑷若用B装置制取氧气,写出相关的文字表达式____________;
⑸通常状况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小。实验室中可以用浓氨水与生石灰在常温下制取氨气。可选用____和_____(填装置代号)装置组合。
【答案】酒精灯 锥形瓶 A (一团)棉花 先将导管移离水面 熄灭酒精灯 用带火星的木条放在集气瓶口,观察木条是否复燃,若木条复燃则气体已集满,反之则未集满 ② 过氧化氢![]() 水+氧气 B D或F
水+氧气 B D或F
【解析】
实验室制取气体主要包含气体的发生装置和收集装置。根据反应物的状态和反应条件,气体的发生装置主要有固固混合加热型和固液混合不加热两种类型,根据生成气体的溶解性和是否与空气中物质反应可用排水法或排空气法收集,排空气法又可以根据气体密度大小分为向上排空气法和向下排空气法。
(1)图中仪器a的名称是酒精灯,b是锥形瓶,故填酒精灯、锥形瓶;
(2)高锰酸钾为固体,反应条件是加热,发生装置应选择固固加热型,故填A;加热高锰酸钾时要在试管口放一团棉花防止加热时高锰酸钾粉末进入导管,故填(一团)棉花;排水法收集气体结束后,如果先熄灭酒精灯会导致试管内气体压强减小,水槽中的水倒吸进试管,使试管炸裂,故填先将导管移离水面,熄灭酒精灯;
(3)检验氧气是否集满用带火星的木条放在集气瓶口,验证氧气能使带火星木条复燃的性质时将带火星木条伸入到集气瓶内,故填用带火星的木条放在集气瓶口,观察木条是否复燃,若木条复燃则气体已集满,反之则未集满;
(4)过氧化氢在常温下能缓慢分解成水和氧气,在过氧化氢溶液中加入二氧化锰时分解加速,适合实验室制取快速氧气,故填过氧化氢![]() 水+氧气;
水+氧气;
(5)浓氨水是液体,生石灰是固体,反应条件是常温不需要加热,反应的发生装置选择固液混合不加热型,氨气极易溶于水不能采用排水法,相同条件下氨气密度比空气小,可采用向下排空气法,故填B、D或F。

【题目】小明同学在家里的药箱中发现一瓶用来清洗伤口用的消毒液——“双氧水”,他联想到在化学课上曾用过氧化氢溶液制取过氧气,他高兴的将家中的“双氧水”拿到学校的实验室,在老师的指导下和同学们一起做了如下实验。
(第一组实验)小明欲证明该双氧水是否失效。
实验过程
①在试管中加入5 mL “双氧水”,把带火星的木条伸入试管中,发现木条未复燃;
②用酒精灯给上述试管加热,液体中有气泡产生,把带火星的木条伸入试管中,发现木条仍未复燃;
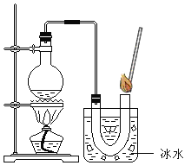
③如图装置进行操作,带火星的木条复燃,
(1)水槽中冰水所起的作用是 __________________________________;
(2)实验结论:___________________________________________________。
(第二组实验)小明想探究CuO能否起到类似MnO2的催化作用。
(3)[猜想]Ⅰ CuO不是催化剂,也不参与反应,反应前后质量和化学性质不变;
Ⅱ CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ CuO是反应的催化剂,反应前后____________________________________
[实验]用天平称量0.2gCuO,取5ml 5%过氧化氢溶液于试管中,进行实验:
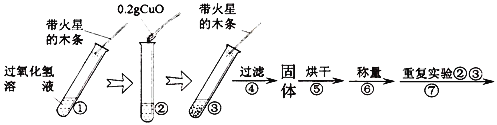
(4)填表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
_______; 带火星木条复燃 | ________ | 溶液中有气泡产生; _____________ | 猜想Ⅰ、Ⅱ不成立 猜想Ⅲ成立 |
(5)步骤①的目的是____________________________
(6)利用该方法获得氧气的化学方程式为________________
(7)步骤④得到的固体是CuO。CuO的相对分子质量是_______________,其中铜元素的质量分数是________________。
【题目】元素周期表是学习和研究化学的重要工具,下图是元素周期表的一部分
族 周期 | ⅠA | O | ||||||
1 | 1H 1.008 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 2He 4..003 |
2 | 3Li 6.941 | 4Be 9.01 | 5B 10.811 | 6C 12.010 | 7N 14.0067 | 8O 15.999 | 9F 18.998 | 10Ne 20.179 |
3 | 11Na 22.989 | 12Mg 24.305 | 13Al 26.981 | 14Si 28.085 | 15P 30.973 | 17Cl 35.452 | 18Ar 39.948 | |
(1)表中第14号元素名称是_____;空白处应该填上的原子序数和元素符号为____________
(2)查出磷元素的相对原子质量是___________ ;
(3)稀有气体的原子结构上有__________的特点。
(4)原子序数为11的元素与17的元素形成的物质名称为_____,由_____和____构成(填微粒符号)。
(5)硫元素的原子结构示意图为  ,该元素的原子核外有______个电子。
,该元素的原子核外有______个电子。
(6)2018年在新疆发现我国最大的铍(Be)矿。此元素原子的核电荷数为__;核外电子层数为____;
(7)同周期元素,从左到右,各元素原子随原子序数的增加,核外电子数依次是________。
(8)从Na、Mg原子结构示意图推知,金属Na、Mg化学性质不同的原因是____________
(9)X2﹣与Ne的核外电子排布相同,则X的元素符号是___,它处在元素周期表中第________周期;