题目内容
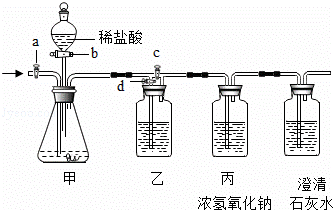
美丽的青海湖不仅让我们感受到自然之美,当地的居民还能从青海湖内“冬天捞碱、夏天捞盐”。当地学校的某化学兴趣小组对捞出来的纯碱进行研究,有的同学认为捞出来的全是碳酸钠,有的同学认为捞出来的纯碱中混有少量的氯化钠。现在他们准备以一包冬天捞出来的纯碱(若含有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的质量分数。小组通过讨论设计了下图中的装置,请你参与探究。(实验前活塞都关闭)
【实验一】称取13.25g纯碱样品完全溶于水,放入甲中,称量丙装置的质量为355g,打开
b、c,甲中现象为 时,再称量丙装置的质量为350.6g,通过计算得出纯碱样品中
碳酸钠的质量分数为 。甲和丙中反应的化学方程式为 、 。
同学们通过讨论认为上述方法并不能准确测量,其理由可能是 。(写一条即可)
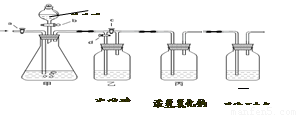
【实验二】通过讨论,改进后的实验步骤如下:
①称量丙装置的质量。
②称量样品,检查装置气密性。
③关闭a,打开b,注入足量的稀盐酸。
④打开a、d,鼓入氮气一会儿。
其正确顺序为 (填字序号,可重复)。
【表达与交流】
(1)此实验中丁装置的作用是 。
(2)此实验中鼓入氮气的作用是 。(2分)
【实验一】不再产生气体 80%
Na2CO3+2HCl= 2NaCl+H2O+CO2↑ CO2+2NaOH= Na2CO3+ H2O
装置中的空气没有排净,其中含有二氧化碳;产生的二氧化碳没有被氢氧化钠溶液吸收;反应中有水蒸气产生等(其他答案合理给分)
【实验二】②④①③④①
【表达与交流】
(1)检验产生的二氧化碳已被完全吸收。
(2)开始时将装置中的空气排净,结束时将产生的二氧化碳全部排入氢氧化钠溶液中吸收。
【解析】
试题分析:【实验一】打开b、c,碳酸钠和稀盐酸接触,等反应停止也就是不再产生二氧化碳时,甲中现象为不再产生气泡,产生二氧化碳的质量为355g-350.6g=4.4g,所以含有碳酸钠为10.6g,纯碱样品中碳酸钠的质量分数为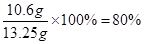 ,甲中的反应为盐酸和碳酸钠的反应,丙中的反应为二氧化碳和氢氧化钠的反应,此装置中原有的二氧化碳没有被完全除尽,其中的二氧化碳会造成误差;【实验二】其正确顺序为②④①③④①,(1)丁中盛放的是氢氧化钙溶液,目的是检验产生的二氧化碳是否已被完全吸收,(2)此实验中鼓入氮气的作用是开始时将装置中的空气排净,结束时将产生的二氧化碳全部排入氢氧化钠溶液中吸收。
,甲中的反应为盐酸和碳酸钠的反应,丙中的反应为二氧化碳和氢氧化钠的反应,此装置中原有的二氧化碳没有被完全除尽,其中的二氧化碳会造成误差;【实验二】其正确顺序为②④①③④①,(1)丁中盛放的是氢氧化钙溶液,目的是检验产生的二氧化碳是否已被完全吸收,(2)此实验中鼓入氮气的作用是开始时将装置中的空气排净,结束时将产生的二氧化碳全部排入氢氧化钠溶液中吸收。
考点:探究纯碱的成分
点评:这是一道非常典型的探究题,重点考察的是化学思想这种题目不要害怕,仔细审题即可。

 阅读快车系列答案
阅读快车系列答案