题目内容
美丽的青海湖不仅让我们感受到自然之美,当地的居民还能从青海湖内“冬天捞碱、夏天捞盐”.当地学校的某化学兴趣小组对捞出来的纯碱进行研究,有的同学认为捞出来的全是碳酸钠,有的同学认为捞出出来的纯碱中常常混有少量的氯化钠.现在他们准备以一包冬天捞出来的纯碱(若含有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的含量.请你参与他们的活动.【小组讨论】
观点I:纯碱样品中只含有碳酸钠;
观点II:纯碱样品是由碳酸钠和少量氯化钠组成的混合物.
【实验设计】
甲方案:
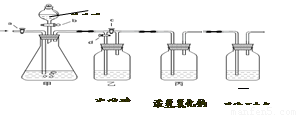
(1)称取13.25g纯碱样品,加入过量的澄清石灰水,充分搅拌.过滤、洗涤、干燥,得到白色沉淀10.00g;
(2)数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数;
(3)计算过程:
(4)实验结论______.
乙方案
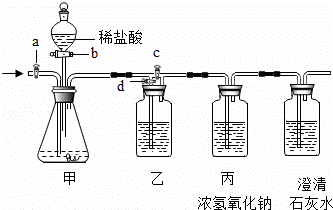
(1)称取样品质量为a g,测得样品与足量稀硫酸完全反应生成二氧化碳的质量为b g
(2)实验结论:
①当a、b的质量关系满足______(填写含ab字母的表达式,下同)时,纯碱样品中含有碳酸钠,样品中碳酸钠的质量分数是100%;
②当a、b的质量关系满足______时,纯碱样品中含有碳酸钠,样品中碳酸钠的质量分数是______;
【实验评价】
误差分析:①甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小,
②乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比______(填写“偏大”、“偏小”或“不变”).
【交流反思】
(1)实验过程中,需用玻璃棒不断搅拌,该操作的目的是______;
(2)甲方按实验操作中,对沉淀洗涤的目的是:______;
(3)乙方案中,需用一定质量的19.6%的稀硫酸.现有一瓶98%的浓硫酸(密度为1.84g/cm2),配制乙方案中实验所用稀硫酸,至少需要浓硫酸的体积是______mL(填写含字母的表达式).
【答案】分析:【小组讨论】
甲方案:(3)计算过程:根据样品与石灰水反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数;
(4)实验结论:根据计算,分析判断样品的组成;
乙方案:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
【实验评价】②乙方案中,根据生成的二氧化碳气体因溶解于水分析对计算的结果的影响;
【交流反思】
(1)根据玻璃棒的作用分析;
(2)通过洗涤,可以除去沉淀表面杂质,减少误差;
(3)根据稀释溶液时溶质的质量不变进行计算.
解答:解:【小组讨论】甲方案:
设纯碱样品中含Na2CO3的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 10.00g
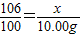 x=10.60g
x=10.60g
纯碱样品中Na2CO3的质量分数为: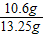 ×100%=80%
×100%=80%
由此得出的结论是:纯碱样品是由碳酸钠和少量氯化钠组成的混合物,且样品中碳酸钠的质量分数是80%;
乙方案:由Na2CO3与硫酸的反应:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
可知:(1)当a、b的质量关系满足 =
=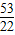 时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.
时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.
(2)当a、b的质量关系满足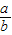 >
>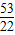 ,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是
,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是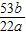 ×100%.
×100%.
【实验评价】
②乙方案中,由于有部分生成的二氧化碳气体因溶解于水而没有全部逸出,再根据二氧化碳计算出的碳酸钠质量偏小,从而计算出的碳酸钠的质量分数也偏小;
【交流反思】
(1)实验过程中,通过玻璃棒不断搅拌,可以使反应充分反应;
(2)在甲方案实验操作中,通过洗涤可以除去沉淀表面杂质,减少误差;
(3)设生成bg二氧化碳需要硫酸的质量为y
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
98 44
y bg
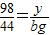 y=
y=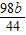 g
g
设配制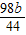 g稀硫酸,至少需要浓硫酸的体积是为:
g稀硫酸,至少需要浓硫酸的体积是为: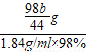 =1.24bmL
=1.24bmL
故答为:【实验设计】甲方案:(4)纯碱样品是由碳酸钠和少量氯化钠组成的混合物,且样品中碳酸钠的质量分数是80%;乙方案:(2)①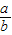 =
=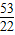 ,②
,②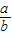 >
>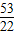 ,
,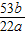 ×100%;【实验评价】②偏小;
×100%;【实验评价】②偏小;
【交流反思】(1)可以使反应充分反应;(2)可以除去沉淀表面杂质,减少误差;(3)1.24b.
点评:本题将计算和实验有机地结合起来进行考查,通过认证审题,结合题干中已给出一系列的提示,根据提出的问题,发现有用的信息,充分发挥联想,与已有的知识建立联系,然后进行类比推导,从而达到解决问题的目的.
甲方案:(3)计算过程:根据样品与石灰水反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数;
(4)实验结论:根据计算,分析判断样品的组成;
乙方案:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
【实验评价】②乙方案中,根据生成的二氧化碳气体因溶解于水分析对计算的结果的影响;
【交流反思】
(1)根据玻璃棒的作用分析;
(2)通过洗涤,可以除去沉淀表面杂质,减少误差;
(3)根据稀释溶液时溶质的质量不变进行计算.
解答:解:【小组讨论】甲方案:
设纯碱样品中含Na2CO3的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 10.00g
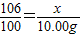 x=10.60g
x=10.60g纯碱样品中Na2CO3的质量分数为:
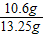 ×100%=80%
×100%=80%由此得出的结论是:纯碱样品是由碳酸钠和少量氯化钠组成的混合物,且样品中碳酸钠的质量分数是80%;
乙方案:由Na2CO3与硫酸的反应:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
可知:(1)当a、b的质量关系满足
 =
=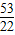 时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.
时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.(2)当a、b的质量关系满足
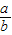 >
>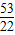 ,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是
,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是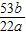 ×100%.
×100%.【实验评价】
②乙方案中,由于有部分生成的二氧化碳气体因溶解于水而没有全部逸出,再根据二氧化碳计算出的碳酸钠质量偏小,从而计算出的碳酸钠的质量分数也偏小;
【交流反思】
(1)实验过程中,通过玻璃棒不断搅拌,可以使反应充分反应;
(2)在甲方案实验操作中,通过洗涤可以除去沉淀表面杂质,减少误差;
(3)设生成bg二氧化碳需要硫酸的质量为y
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
98 44
y bg
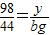 y=
y=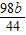 g
g设配制
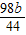 g稀硫酸,至少需要浓硫酸的体积是为:
g稀硫酸,至少需要浓硫酸的体积是为: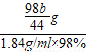 =1.24bmL
=1.24bmL故答为:【实验设计】甲方案:(4)纯碱样品是由碳酸钠和少量氯化钠组成的混合物,且样品中碳酸钠的质量分数是80%;乙方案:(2)①
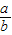 =
=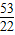 ,②
,②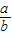 >
>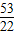 ,
,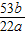 ×100%;【实验评价】②偏小;
×100%;【实验评价】②偏小;【交流反思】(1)可以使反应充分反应;(2)可以除去沉淀表面杂质,减少误差;(3)1.24b.
点评:本题将计算和实验有机地结合起来进行考查,通过认证审题,结合题干中已给出一系列的提示,根据提出的问题,发现有用的信息,充分发挥联想,与已有的知识建立联系,然后进行类比推导,从而达到解决问题的目的.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目