题目内容
(2008?崇文区二模)小刚做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生.是不是拿错了药品?小刚经检验确认没有拿错药品,而是氢氧化钠溶液变质了.【分析】氢氧化钠溶液变质的原因是______.
【提出问题】该氢氧化钠溶液是全部变质还是部分变质?
【查询资料】1.已知反应:BaCl2+Na2CO3═2NaCl+BaCO3↓
2.部分盐溶液的pH如下表:
| 盐溶液 | NaCl | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加足量的氯化钡溶液,并不断振荡. | 说明原来溶液中,一定含有的溶质是碳酸钠. | |
| (2)向步骤(1)充分反应后的溶液中滴加. | 说明原来溶液中,还一定含有. |
【进一步实验】小刚用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验.他设计如图所示的实验方案.

(1)写出步骤①发生反应的化学方程式______;
(2)步骤①中滴加适量溶液A后的操作是______;
(3)步骤③判断盐酸与氢氧化钠恰好完全反应的实验现象是______.
【答案】分析:【分析】根据实验中滴加盐酸有气体放出,可推断氢氧化钠中含有碳酸钠而变质;说明氢氧化钠吸收了空气中二氧化碳;
【实验设计】为检验变质程度,利用碳酸钠与氯化钡反应生成碳酸钡沉淀与氯化钠,可首先使用氯化钡除去变质生成的碳酸钠;然后取上层清液滴加酚酞,如果部分变质,剩余的氢氧化钠能使酚酞变红,如果全部变质,则滴加的酚酞不变色;
【进一步实验】利用氢氧化钙溶液与碳酸钠发生反应生成氢氧化钠和碳酸钙沉淀,向变质的溶液中加入适量的氢氧化钙溶液充分反应后,过滤,除去碳酸钙沉淀后即可得到纯净的氢氧化钠溶液;根据酚酞遇碱变红、遇酸或中性溶液不变红的特点,可向溶液中滴入酚酞判断两者恰好完全反应.
解答:解:【分析】氢氧化钠时碱,能吸收空气中的二氧化碳发生反应生成碳酸钠和水而变质;
故答案为:氢氧化钠与空气中的二氧化碳发生了反应;
【实验设计】(1)加入的氯化钡溶液形成了白色沉淀,说明溶液中含有碳酸钠,与氯化钡生成不溶于水的碳酸钡;
(2)加入过量氯化钡溶液与溶液中的碳酸钠充分反应,生成白色沉淀碳酸钡和氯钠而将碳酸钠全部除去后,上层清液仍可使酚酞变成红色,说明清液中含有氢氧化钠;
故答案为:
【进一步实验】①氢氧化钠的提纯可采用沉淀法,可用含Ca2+或Ba2+的溶液,为了不加入其它的杂质离子,因此可选用适量的Ca(OH)2溶液,Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,这样可将原溶液中的碳酸根离子形成碳酸钙沉淀,然后通过过滤除去难溶杂质,滤液即为纯净的氢氧化钠溶液.在进行中和反应时,为判断恰好完反应,可先取样品,并滴加酚酞试液,溶液就会变红,搅拌均匀,然后再逐滴加入稀盐酸,红色溶液会变浅,若红色刚好褪去,就说明氢氧化钠和盐酸恰好完全反应.
故答案为:(1)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;(2)过滤;(3)溶液由红色刚好变为无色
点评:本题以变质的氢氧化钠溶液引题,考查变质原因,会书写化学方程式,结合检验方法,解题思路比较灵活,既能考查氢氧化钠和碳酸盐的性质,碳酸根的检验和碳酸盐杂质的除去,又考查了像过滤、搅拌等实验操作,考查面较广,不错的一道题.
【实验设计】为检验变质程度,利用碳酸钠与氯化钡反应生成碳酸钡沉淀与氯化钠,可首先使用氯化钡除去变质生成的碳酸钠;然后取上层清液滴加酚酞,如果部分变质,剩余的氢氧化钠能使酚酞变红,如果全部变质,则滴加的酚酞不变色;
【进一步实验】利用氢氧化钙溶液与碳酸钠发生反应生成氢氧化钠和碳酸钙沉淀,向变质的溶液中加入适量的氢氧化钙溶液充分反应后,过滤,除去碳酸钙沉淀后即可得到纯净的氢氧化钠溶液;根据酚酞遇碱变红、遇酸或中性溶液不变红的特点,可向溶液中滴入酚酞判断两者恰好完全反应.
解答:解:【分析】氢氧化钠时碱,能吸收空气中的二氧化碳发生反应生成碳酸钠和水而变质;
故答案为:氢氧化钠与空气中的二氧化碳发生了反应;
【实验设计】(1)加入的氯化钡溶液形成了白色沉淀,说明溶液中含有碳酸钠,与氯化钡生成不溶于水的碳酸钡;
(2)加入过量氯化钡溶液与溶液中的碳酸钠充分反应,生成白色沉淀碳酸钡和氯钠而将碳酸钠全部除去后,上层清液仍可使酚酞变成红色,说明清液中含有氢氧化钠;
故答案为:
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡. | 有白色沉淀产生 | 说明原溶液中一定含有 Na2CO3 |
| (2)取(1)试管中的上层清液滴加 酚酞试液 | 溶液变为红色 | 则溶液中一定含有NaOH |
故答案为:(1)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;(2)过滤;(3)溶液由红色刚好变为无色
点评:本题以变质的氢氧化钠溶液引题,考查变质原因,会书写化学方程式,结合检验方法,解题思路比较灵活,既能考查氢氧化钠和碳酸盐的性质,碳酸根的检验和碳酸盐杂质的除去,又考查了像过滤、搅拌等实验操作,考查面较广,不错的一道题.

练习册系列答案
相关题目
(2008?崇文区二模)小刚做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生.是不是拿错了药品?小刚经检验确认没有拿错药品,而是氢氧化钠溶液变质了.
【分析】氢氧化钠溶液变质的原因是______.
【提出问题】该氢氧化钠溶液是全部变质还是部分变质?
【查询资料】1.已知反应:BaCl2+Na2CO3═2NaCl+BaCO3↓
2.部分盐溶液的pH如下表:
【实验设计】小刚依据查询的资料设计实验步骤,请你帮他补充完整.
【实验结论】通过实验,小刚检验出该氢氧化钠溶液只是部分变质.
【进一步实验】小刚用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验.他设计如图所示的实验方案.
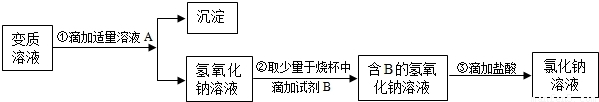
(1)写出步骤①发生反应的化学方程式______;
(2)步骤①中滴加适量溶液A后的操作是______;
(3)步骤③判断盐酸与氢氧化钠恰好完全反应的实验现象是______.
【分析】氢氧化钠溶液变质的原因是______.
【提出问题】该氢氧化钠溶液是全部变质还是部分变质?
【查询资料】1.已知反应:BaCl2+Na2CO3═2NaCl+BaCO3↓
2.部分盐溶液的pH如下表:
| 盐溶液 | NaCl | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加足量的氯化钡溶液,并不断振荡. | 说明原来溶液中,一定含有的溶质是碳酸钠. | |
| (2)向步骤(1)充分反应后的溶液中滴加. | 说明原来溶液中,还一定含有. |
【进一步实验】小刚用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验.他设计如图所示的实验方案.

(1)写出步骤①发生反应的化学方程式______;
(2)步骤①中滴加适量溶液A后的操作是______;
(3)步骤③判断盐酸与氢氧化钠恰好完全反应的实验现象是______.
 (2008?崇文区二模)如图是某试剂瓶上已经部分被污损和腐蚀的标签.小明想探究其成分,他取一支洁净的试管,加入少量试剂瓶中的固体,滴入少量盐酸,有无色无味气泡产生.该气体能使澄清石灰水变浑浊,则该固体( )
(2008?崇文区二模)如图是某试剂瓶上已经部分被污损和腐蚀的标签.小明想探究其成分,他取一支洁净的试管,加入少量试剂瓶中的固体,滴入少量盐酸,有无色无味气泡产生.该气体能使澄清石灰水变浑浊,则该固体( ) (2008?崇文区二模)如图是某试剂瓶上已经部分被污损和腐蚀的标签.小明想探究其成分,他取一支洁净的试管,加入少量试剂瓶中的固体,滴入少量盐酸,有无色无味气泡产生.该气体能使澄清石灰水变浑浊,则该固体( )
(2008?崇文区二模)如图是某试剂瓶上已经部分被污损和腐蚀的标签.小明想探究其成分,他取一支洁净的试管,加入少量试剂瓶中的固体,滴入少量盐酸,有无色无味气泡产生.该气体能使澄清石灰水变浑浊,则该固体( )