题目内容
【题目】将5%的NaOH溶液逐滴加入到10g稀硫酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示.边回答:
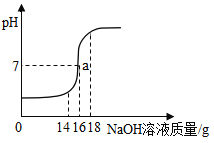
(1)a点的含义是_________________;
(2)当计入NaOH溶液的质量为18g时,溶液中存在的阴离子有_____________;
(3)稀硫酸中溶质的质量分数为____。
【答案】当加入NaOH溶液的质量为16g时,硫酸与氢氧化钠恰好完全中和 硫酸根离子与氢氧根离子 9.8%
【解析】
(1)a点的含义是:当加入NaOH溶液的质量为16g时,硫酸与氢氧化钠恰好完全中和.
故填:当加入NaOH溶液的质量为16g时,硫酸与氢氧化钠恰好完全中和.
(2)当计入NaOH溶液的质量为18g时,氢氧化钠过量,此时溶液中存在的阴离子有硫酸根离子与氢氧根离子.
故填:硫酸根离子与氢氧根离子.
(3)设10g稀硫酸中硫酸质量为x,
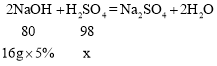
![]()
解得x=0.98g,
稀硫酸中溶质的质量分数为:![]() 。
。
答:稀硫酸中溶质的质量分数为9.8%.

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案【题目】某实验小组的同学测得人体呼吸的气体成分如下表。(查资料知:无水硫酸铜为白色固体,遇水变为蓝色固体)请回答:
气体 | 吸人气体(体积分数) | 呼出气体(体积分数) |
N2 | 78% | 75% |
O2 | 21% | 15% |
CO2 | 0.03% | 3.68% |
H2O | 0.06% | 5.44% |
其他 | 0.91% | 0.88% |
(1)下列鉴别空气和呼出气体的方法中,可行的是_________________________________(填字母代号)。
A分别通过澄清的石灰水
B用燃着的木条检验
C用带火星的木条检验
D用手在集气瓶口扇动,闻气体的气味
(2)小组内某同学在测量吸入气体中氧气含量时,用碳代替红磷,发现集气瓶内并没有吸入水,其原因是_________________________________。

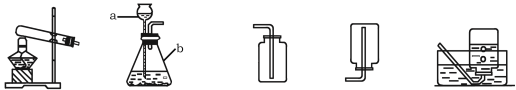
(3)利用下图装置A、B可证明呼出的气体中含有二氧化碳和水蒸气。A装置内应加入的物质是_________________________________;呼出气体与A、B装置的正确连接顺序是呼出气体→_________________________________(填导管口字母代号)。

(4)氮气在呼吸过程中没有参与化学反应,但在呼出的气体中体积分数却明显减小了,原因是_________________________________。