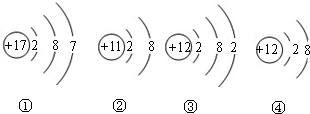题目内容
6月5日是世界环境日,2005年世界环境日主题为“营造绿色城市,呵护地球家园”,开发海洋,维持海洋的可持续发展是每个地球公民的神圣职责.请回答下面关于海洋的几个问题:【问题一】近年,我国沿海经常发生大面积的“赤潮”,造成养殖业重大损失.赤潮的发生主要是与因为藻类的疯狂生长,与藻类疯长的密切相关的元素是______和______.(填元素符号)
【问题二】海水中资源丰富,含量最多的金属阳离子是______(填符号),含量最多的分子是______(填符号).
【问题三】盐场海水晒盐的原理是______.
A、氯化钠的溶解度受温度影响较大
B、因氯化钠溶解度受温度影响不大,故采取蒸发水分的方法
所得粗盐中主要含泥砂、氯化镁、氯化钙等杂质,现对其进行提纯,主要操作流程如下:

(1)操作①的名称是______,操作②的名称是______.
(2)A溶液是______,B溶液是______.(选择合适序号填空)
a、NaOH 和Na2CO3; b、KOH和 K2CO3; c、H2SO4; d、HCl
【问题四】经勘察,深海下含有丰富的“可燃冰”,可满足人类1000年的能源需要.该物质是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子.若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为______.
A、CH4?14H2O B、CH4?8H2O
C、CH4?(23/3)H2O D、CH4?6H2O
若该水合物可表示为CH4?nH2O,则其与氧气完全燃烧的方程式如下,请将括号中的化学计量数补充完整:CH4?nH2O+2O2
 CO2+(n+2)H2O.
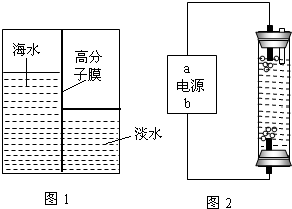
CO2+(n+2)H2O.【问题五】海水淡化是国际上研究的热点问题,我国科学家在利用高分子膜进行海水淡化的研究上取得了一些成绩.如图,左侧为海水,右侧为经过一段时间后由左侧经高分子膜渗透得到的淡水,该变化是______变化(填物理或化学).
【问题六】如图为某学生制作的一种家用环保型消毒液发生器:原理是电解饱和氯化钠溶液,制得的消毒液有较强的杀菌能力,该反应是利用氯化钠和水在电解条件下生成NaOH、H2和Cl2,请完成化学方程式.______ 2NaOH+H2↑+Cl2↑

【答案】分析:本题应注意把课本所学知识和题中信息相结合,把握信息中的关键来灵活解答.
问题一:利用水体富营养化的原因来解答;
问题二:根据海水的成分和含量来解答;
问题三:根据氯化钠的溶解度分析海水晒盐的原理,利用不引入新的杂质,且将杂质离子转化为沉淀的方法来分析;
问题四:根据分子个数确定组成,利用原子守恒来配平化学方程式;
问题五:利用物质是否发生变化,是否有新物质生成来判断反应是物质变化还是化学变化;
问题六:根据反应物和生成物来书写化学方程式,要注意铁在溶液里发生置换反应时铁只能显示+2价.
解答:解:问题一:海水富营养化,主要是因为陆地上排放的污水中含有较多的氮、磷元素,导致藻类疯长,故答案为:N、P;
问题二:海水中含量最多的金属是钠元素,钠是很活泼的,在自然界里以离子形式存在,海水中最多的物质是水,水是由水分子构成的,故答案为:Na+、H2O;
问题三:因氯化钠溶解度受温度影响不大,海水晒盐主要是蒸发水分,故选B;
(1)主要利用泥砂不溶于水,采用过滤的方法除去,从氯化钠溶液中得到氯化钠晶体,应采用蒸发溶剂得到晶体,故答案为:
过滤;蒸发溶剂;
(2)除去氯化镁、氯化钙等杂质,实质是除去钙、镁离子,应用碱和碳酸盐将其转化为沉淀,并用酸将过量碱和碳酸盐反应掉,故答案为:a;d;
问题四:因晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子.若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则该化合物为可表示为6CH4?48H2O,即平均组成可表示CH4?8H2O,故选B;
根据H原子守恒可知,反应前有4+2n个H原子,则反应后水的系数为n+2,故答案为:n+2;
问题五:用高分子膜使海水淡化,类似于过滤,没有生成其他物质,所以海水淡化是物理变化,故答案为:物理;
问题六:由题意知反应物是氯化钠和水,生成物是氢氧化钠、氢气和氯气,反应条件是通电,因此根据化学方程式书写规则即可得化学方程式2NaCl+2H2O 2NaOH+H2↑+Cl2↑;铁与稀硫酸反应生成硫酸亚铁和氢气,所以的化学方程式Fe+H2SO4=FeSO4+H2↑,这是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应.
2NaOH+H2↑+Cl2↑;铁与稀硫酸反应生成硫酸亚铁和氢气,所以的化学方程式Fe+H2SO4=FeSO4+H2↑,这是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应.
故答案为:
2NaCl+2H2O 2NaOH+H2↑+Cl2↑;Fe+H2SO4=FeSO4+H2↑;置换.
2NaOH+H2↑+Cl2↑;Fe+H2SO4=FeSO4+H2↑;置换.
点评:本题主要考查了水资源的污染和防治,并以此为核心综合了水的净化和化学方程式的书写,难度较大,涉及的内容多,要求学生具备牢固的基础.具有综合解决问题的能力.
问题一:利用水体富营养化的原因来解答;
问题二:根据海水的成分和含量来解答;
问题三:根据氯化钠的溶解度分析海水晒盐的原理,利用不引入新的杂质,且将杂质离子转化为沉淀的方法来分析;
问题四:根据分子个数确定组成,利用原子守恒来配平化学方程式;
问题五:利用物质是否发生变化,是否有新物质生成来判断反应是物质变化还是化学变化;
问题六:根据反应物和生成物来书写化学方程式,要注意铁在溶液里发生置换反应时铁只能显示+2价.
解答:解:问题一:海水富营养化,主要是因为陆地上排放的污水中含有较多的氮、磷元素,导致藻类疯长,故答案为:N、P;
问题二:海水中含量最多的金属是钠元素,钠是很活泼的,在自然界里以离子形式存在,海水中最多的物质是水,水是由水分子构成的,故答案为:Na+、H2O;
问题三:因氯化钠溶解度受温度影响不大,海水晒盐主要是蒸发水分,故选B;
(1)主要利用泥砂不溶于水,采用过滤的方法除去,从氯化钠溶液中得到氯化钠晶体,应采用蒸发溶剂得到晶体,故答案为:
过滤;蒸发溶剂;
(2)除去氯化镁、氯化钙等杂质,实质是除去钙、镁离子,应用碱和碳酸盐将其转化为沉淀,并用酸将过量碱和碳酸盐反应掉,故答案为:a;d;
问题四:因晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子.若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则该化合物为可表示为6CH4?48H2O,即平均组成可表示CH4?8H2O,故选B;
根据H原子守恒可知,反应前有4+2n个H原子,则反应后水的系数为n+2,故答案为:n+2;
问题五:用高分子膜使海水淡化,类似于过滤,没有生成其他物质,所以海水淡化是物理变化,故答案为:物理;
问题六:由题意知反应物是氯化钠和水,生成物是氢氧化钠、氢气和氯气,反应条件是通电,因此根据化学方程式书写规则即可得化学方程式2NaCl+2H2O
 2NaOH+H2↑+Cl2↑;铁与稀硫酸反应生成硫酸亚铁和氢气,所以的化学方程式Fe+H2SO4=FeSO4+H2↑,这是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应.
2NaOH+H2↑+Cl2↑;铁与稀硫酸反应生成硫酸亚铁和氢气,所以的化学方程式Fe+H2SO4=FeSO4+H2↑,这是一种单质和一种化合物反应生成另一种单质和另一种化合物,属于置换反应.故答案为:
2NaCl+2H2O
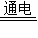 2NaOH+H2↑+Cl2↑;Fe+H2SO4=FeSO4+H2↑;置换.
2NaOH+H2↑+Cl2↑;Fe+H2SO4=FeSO4+H2↑;置换.点评:本题主要考查了水资源的污染和防治,并以此为核心综合了水的净化和化学方程式的书写,难度较大,涉及的内容多,要求学生具备牢固的基础.具有综合解决问题的能力.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
 6月5日是世界环境日,今年的主题是“海洋存亡,匹夫有责”,开发海洋,维持海洋的可持续发展是每个地球公民的神圣职责.请回答下面关于海洋的几个问题:
6月5日是世界环境日,今年的主题是“海洋存亡,匹夫有责”,开发海洋,维持海洋的可持续发展是每个地球公民的神圣职责.请回答下面关于海洋的几个问题: