题目内容
【题目】下列图像能正确反应对应变化的是(____)
A |
| 向一定质量的盐酸中加入镁粉至过量 |
B |
| 向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液 |
C |
| 加热一定量的高锰酸钾固体 |
D |
| 向氢氧化钠溶液中加入X,X可能是________ |
A. A B. B C. C D. D
【答案】 C 水(或氯化钠溶液等,合理即可)
【解析】A、镁和稀盐酸反应生成氯化镁和氢气,氯化镁的质量从零开始逐渐增加,反应完全后,其质量不在变化,故A错误;B、根据铁和硫酸铜反应的化学方程式:Fe+CuSO4═Cu+FeSO4可以判断消耗的铁的质量要小于生成的铜的质量,所以可以判断反应后金属的质量增加,故B错误;C、高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,剩余固体中锰元素质量不变,故C正确;故选:C。

【题目】为探究锌、铜、铬三种金属的性质,某兴趣小组进行如下实验。
【实验一】将三种金属丝分别与一节干电池和小电珠连接,小电珠发光。
【实验二】取粗细、长短相同的锌丝、铜丝、铬丝均与50mL稀硫酸反应,实验记录如下:
锌 | 铜 | 铬 | 铜 | |
稀硫酸的质量分数 | 5% | 5% | 15% | 15% |
反应现象 | 少量气泡 | 无现象 | 许多气泡 | 无现象 |
【实验三】金属锌、铜和稀硫酸构成如图所示的化学电池装置,观察到铜片表面有气泡(H2),小电珠发光。
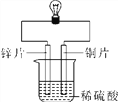
(1)实验一的现象说明三种金属都具有____________性;
(2)铬与稀硫酸反应生成硫酸亚铬(CrSO4)和氢气,反应的化学方程式是______________________________________;该反应属于________________(填基本反应类型)反应;
(3)要判断三种金属活动性强弱,必须在实验二的基础上增补一个实验才能得出结论,其实验内容是把粗细、长短相同的________________放入________________的50mL稀硫酸中,观察放出气泡的快慢;
(4)金属活动性强弱是由金属物质的结构决定的,不会因某个实验而改变。下列关于实验三分析正确的是______(填序号)。
A.铜的金属活动性变得比锌强
B.铜与稀盐酸发生了置换反应
C.该装置将化学能转化为电能







