题目内容
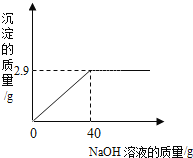
【题目】某同学测定一瓶标签残缺的硫酸镁溶液的溶质质量分数,取60g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示。反应方程式为:![]() 。
。
(1)配制100g溶质质量分数为10%的![]() 溶液,需
溶液,需![]() 的质量为________g。
的质量为________g。
(2)计算![]() 溶液中溶质的质量分数________(列式计算)。
溶液中溶质的质量分数________(列式计算)。
【答案】10 10%
【解析】
(1)根据溶液的质量和质量分数求算溶质的质量。
(2)根据生成的氢氧化镁的质量和对应的化学方程式求算硫酸镁的质量,进而求算其质量分数。
(1)配制100g溶质质量分数为10%的NaOH溶液,需NaOH的质量为100g×10%=10g。故填:10。
(2)由图可以看出生成的氢氧化镁的质量为2.9g
设硫酸镁的质量为x。
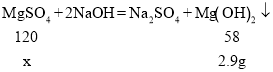
![]()
![]()
溶液中的硫酸镁的质量分数![]()
答:MgSO4溶液中溶质的质量分数为10%。

练习册系列答案
相关题目
【题目】某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
反应过程 | 反应前 | 反应后 |
质量变化(不含容量质量) | 34.3g | 32.7g |
若反应后,双氧水分解完全且氧气全部逸出,该同学得出的结论中,不合理的是:
A.反应速率逐渐加快 B.最多得到氧气的质量为1.6g
C.催化剂二氧化锰的质量为0.3g D.反应得到水和氧气的质量比为9:8