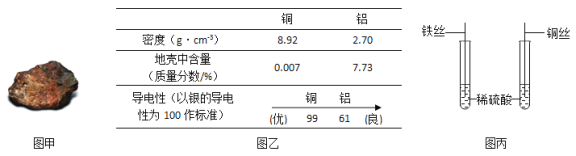
题目内容
【题目】课外小组研究“影响H2O2 生成O2反应速率的因素”的课题。通过查阅资料,他们提出如下猜想。
(提出猜想)催化剂和反应物浓度都会影响H2O2 生成O2 的反应速率
(实验过程)实验装置如图:

实验操作:检查装置的气密性良好。 将分液漏斗中的液体加入锥形瓶中,立即收集一瓶放出的气体。
实验记录:
实验编号 | ① | ② | ③ |
反应物 | 5%H2O2 50 mL | 5%H2O2 | 3%H2O250 mL |
加入固体 | 0.5gCuO | 0.5gMnO2 | 0.5gMnO2 |
收集等体积O2所需时间 | 105 s | 45s | 78 s |
(1)实验②中加入H2O2溶液的体积为__________mL;
(2)充分反应后,将实验②中剩余物质里的MnO2提取的方法是_____________;
(实验结论)该探究过程得出的结论是 ____________________________________;
(实验反思) H2O2在常温加入MnO2 后反应速率加快。小敏提出,为了更好的证明二氧化锰是否对H2O2 生成O2的反应速率有影响,还应该增加一组对比实验:该对比实验选用的药品和用量分别为________;小敏发现用收集的气体进行铁丝燃烧实验时,没有产生明显的火星四射现象,出现这种实验结果的原因可能是:_______________________________________________。
【答案】50 过滤,洗涤干燥 使用催化剂和增大双氧水的浓度都会加快反应速率 50mL5%双氧水(不加催化剂)或50mL3%双氧水(不加催化剂) 刚有气泡产生就收集气体,致气体不纯
【解析】
[实验过程]
(1)从实验记录①和②中可以看出,它们中分别加入的是不同的物质作催化剂,是探究影响化学反应速率的催化剂因素,再结合对比试验中的控制变量法(实验中只能有一个量不同),可知过氧化氢溶液的量应相同,故为50mL。
(2)由于MnO2是该反应的催化剂,故充分反应后不变,又因为MnO2不溶于水,故要将实验②中剩余物质里的MnO2提取,可用过滤,洗涤干燥的方法。
[实验结论]
根据实验①②的对比可知,使用催化剂会加快反应速率;根据实验②③的对比可知,增大双氧水的浓度会加快反应速率。故该探究过程得出的结论是使用催化剂和增大双氧水的浓度都会加快反应速率。
[实验反思]
要证明二氧化锰是否对H2O2生成O2的反应速率有影响,还应该增加一个不使用MnO2作催化剂的对照组,进行对比实验,故该实验选用的药品和用量为50mL5%双氧水(不加催化剂)或50mL3%双氧水(不加催化剂)。
小敏发现用收集的气体进行铁丝燃烧实验时,没有产生明显的火星四射现象,出现这种实验结果的原因可能是所收集到的氧气不纯造成的,因为在加入双氧水后立即就收集,首先排出的是锥形瓶内的空气,使收集的气体中氧气的纯度不高,导致实验现象不明显。

【题目】下列归纳总结完全正确的一组是( )
A.分子的特征 | B.数字“2”的含义 |
①水分子很小 ②固体物质的分子不运动 ③气体分子间的间隔很大 | ①Fe2+:1个亚铁离子带2个单位正电荷 ② ③NO2:1个二氧化氮分子中含有2个原子 |
C. 生活经验 | D.节约资源 |
①常用钢刷擦洗铝制品 ②食品包装中抽真空防腐 ③用汽油洗去衣服上的油污 | ①提倡使用太阳能 ②回收利用废旧金属 ③农业灌溉采用滴灌 |
A.AB.BC.CD.D