题目内容
【题目】下列是初中化学常见的基本实验,回答以下问题。
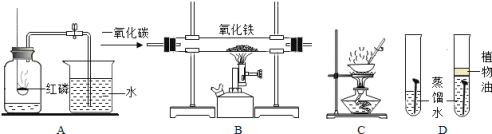
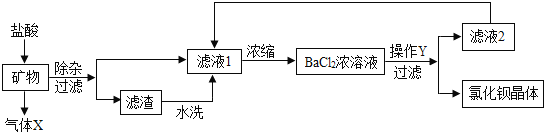
(1)A实验中,测定空气中氧气含量导致实验结果偏小的可能的原因有___________。(填一个合理的即可)
(2)B实验中,硬质玻璃管内发生反应的实验现象是_______________。
(3)C实验中,蒸发时用玻璃棒搅拌是为了_________________。
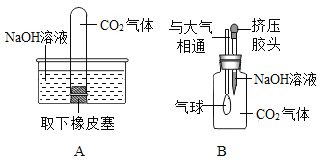
(4)D实验中,探究铁制品锈蚀的条件时,还应补充的一个实验是____________(简述操作)。
【答案】装置漏气(或红磷量不足等合理即可) 红色粉末逐渐变为黑色 防止局部温度过高造成液体飞溅 将同样的铁钉放入一装有干燥空气的试管中
【解析】
(1)在测定空气中氧气含量的试验中,导致实验结果偏小的原因较多。例如:如果红磷的量不足,不能全部消耗氧气,导致实验结果偏小;如果装置漏气,使进入装置中的水偏少,会使实验结果偏小等;
(2)由于在高温条件下,一氧化碳将氧化铁还原成铁,所以实验的现象是:红色粉末逐渐变成黑色;
(3)蒸发时用玻璃棒搅拌是为了使液体均匀受热,防止液体等溅出;
(4)铁生锈的条件是铁与水、氧气接触,在上述试验中,探究了铁与水、氧气同时接触,铁与水的接触,还缺少铁与氧气的接触。所以,应补充的实验是:将铁钉放在干燥的试管中,并塞好橡皮塞。

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目